Este relatório descreve um experimento para calcular o calor de fusão do 1,4-dioxano através da medição da variação de temperatura durante o processo de fusão. Amostras de 1,4-dioxano sólido foram aquecidas em um calorímetro e a temperatura foi monitorada até completar a fusão. Usando os dados de temperatura coletados, o calor absorvido durante a fusão foi calculado e usado para determinar o calor de fusão do composto, que foi encontrado para ser aproximadamente 12.332,46 J, próximo ao


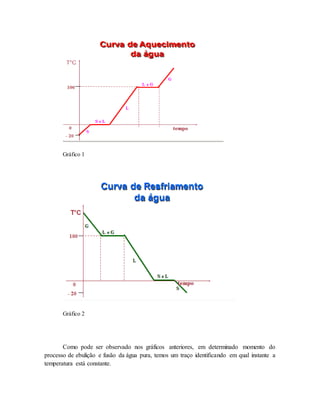




![A fusão é caracterizada como a passagem de uma substância no estado de agregação
sólido para o líquido, tal processo, à pressão constante, envolve absorção de energia, ou seja,
faz-se necessário fornecer energia (calor) ao meio. À medida que o calor é cedido, ocorre o
aumento da temperatura, que continuará aumentando até que se atinja o ponto de fusão. Nesta
específica faixa de temperatura, a concessão de energia continuará, porém a temperatura
permanecerá estável, tal fato é justificado pelo consumo de energia envolvido na
transformação de fases (rompimento do retículo cristalino ou mudança das interações
intermoleculares). Durante esta etapa coexiste sólido e líquido.
Para o processo de vaporização ou condensação o raciocínio é o mesmo acima,
considerando um processo isobárico (pressão constante). Caso houvesse pressões e
temperaturas distintas poder-se utilizar a equação Clapeyron-Clausius:
dT/dp = [T(VS – Vl)] / ΔFH
Onde: VS = Volume da substância sólida;
Vl = Volume da substância líquida.
Para processos reversíveis, a entropia da transição de fase é calculada de acordo com
a segunda lei da termodinâmica. A entropia de fusão pode ser determinada por:
9073 J
Q calorímetro + Q H2O = - (Q aquec. do dioxano sólido + ΔH fusão do dioxano + Q
aquec. do dioxano líquido + Q aquecimento do tubo)
-7735,67 J = - (0,5 x 147,6 x 25,3) + 0,5 x ΔH fusão do dioxano + 0,5 x 152,7 x
(20,95-16,25) + 670 J
ΔH fusão do dioxano = 5965,1725 x2
Desconsiderando o valor Q aquecimento do tubo, ΔH fusão do dioxano = 11930,345
Joules. Aproximadamente =11930 J .
Sendo o Teórico ΔH fusão do dioxano= 12 800J
Percebeu-se que levando em consideração o valor Q de aquecimento do tubo, o valor
da entalpia de fusão do dioxano ficava muito diferente do padrão estabelecido pela literatura,
logo, ao desconsiderá-lo o percentual de erro foi somente de 6,79%. Acredita-se que o valor
Q de aquecimento do tubo é uma medida muito pequena, que devido às condições do
experimento não houve sensibilidade suficiente para tal precisão, logo ao desconsiderá-lo,
teve-se o resultado bem próximo do real.](https://image.slidesharecdn.com/relatorio1fisqui3-170225150957/85/Relatorio-1-fisqui-3-8-320.jpg)
