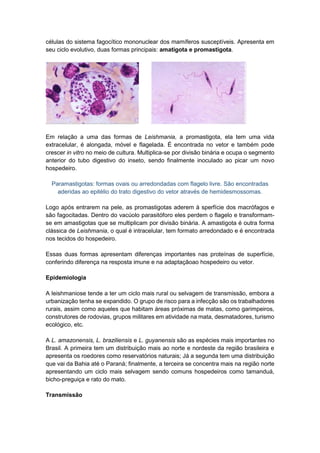
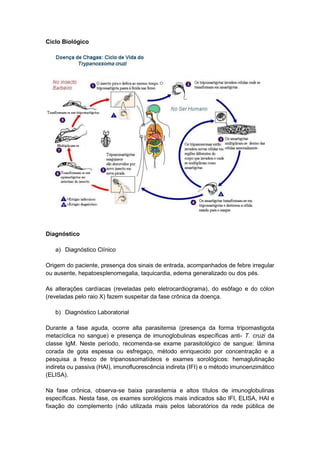
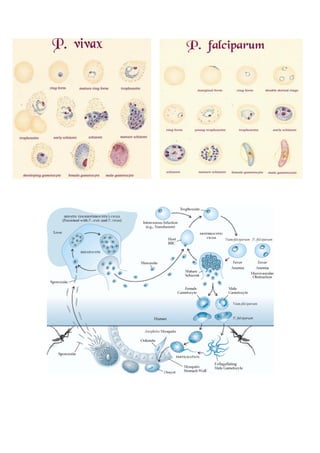
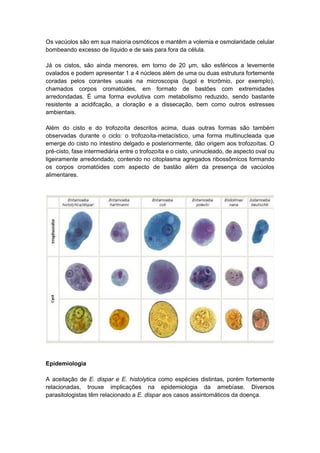
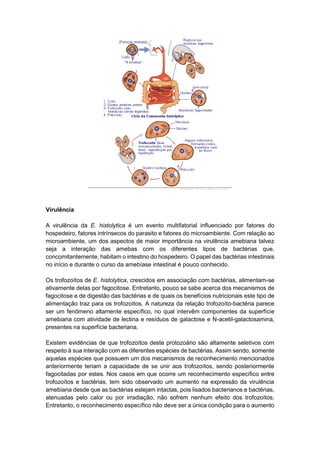
O documento discute conceitos fundamentais da parasitologia, incluindo: 1) a definição de parasitologia e os principais filos de parasitas estudados; 2) conceitos-chave como agente etiológico, endemia e tipos de hospedeiro; 3) os principais tipos de parasitismo e ciclos de vida dos parasitas.