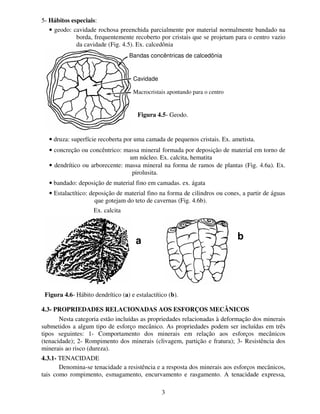
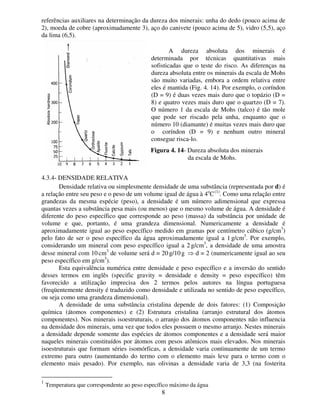
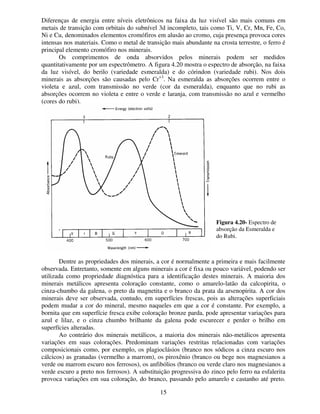
1. O documento discute as propriedades físicas dos minerais, incluindo hábito, tenacidade e tipos de rompimento como clivagem e fratura.
2. Hábito descreve a forma como os minerais ocorrem, variando de cristais isolados a agregados. Tenacidade mede a resistência do mineral a esforços mecânicos.
3. Rompimento pode ocorrer por clivagem ao longo de planos cristalográficos fracos ou por fratura irregular, dependendo da estrutura do mineral.