O documento discute os problemas ambientais causados pela indústria química, especialmente a poluição do ar por óxidos de nitrogênio e enxofre provenientes da queima de combustíveis fósseis nas termoelétricas. Apesar de chaminés altas terem reduzido a poluição local, esses gases permanecem na atmosfera por mais tempo e contribuem para a formação de chuva ácida em larga escala.
![REVISÃO ESTADUAIS
PROF FÁBIO OISIOVICI
01. A utilização do isótopo 92U235, na obtenção de energia,voltou a ser
tema de discussão, após a detecção deelevados níveis de radiação
provocados pelo vazamentode radionuclídeos53I131 e 55Cs137, produtos da
fissãonuclear do urânio 235, na usina nuclear de Fukushima,no Japão,
atingida por um terremoto e por uma tsunami.Considerando-se essas
informações, as propriedadese a posição desses elementos químicos na
Tabela Periódica, é correto afirmar:
a) O radionuclídeo urânio 235 tem o dobro de nêutronsdo isótopo iodo
131.
b ) O raio covalente doradionuclídeo iodo 131 é maior do que o do isótopo
urânio 235.
c) O núcleo do urânio 235 tem menor número de partículas do que a soma
das partículas nucleares dos radionuclídeos césio 137 e iodo 131.
d) As configurações eletrônicas dos radionuclídeos iodo 131 e césio 137
são representadas, respectivamente, por [Kr] 5s2 5p5 e [Kr] 6s2.
e) A energia necessária para retirar os elétrons da camada de valência do
radionuclídeo urânio 235 está relacionada à sua utilização como
combustível nuclear.
02.](https://image.slidesharecdn.com/estaduais2014-131105133746-phpapp01/75/Estaduais2014-1-2048.jpg)
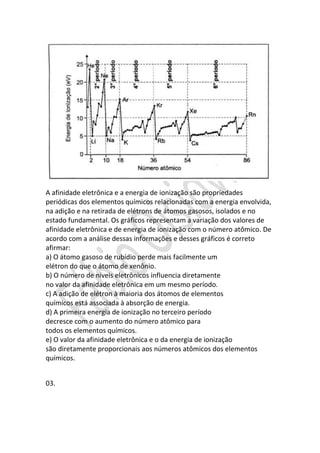




![b) o aproveitamento de subprodutos que seriam descartados como
efluentes nos rios e mares.
c) a extração e a purificação de minérios e de petróleo como matériaprima na produção de novos materiais.
d) a fabricação de agrotóxicos organoclorados, que são produtos químicos
inócuos para o ser humano e o ambiente.
e) a utilização de combustíveis que não liberam gases de efeito estufa
durante a combustão, como o etanol e o carvão vegetal
10.
O tecnécio não ocorre na natureza, foi o primeiro elemento
químico obtido artificialmente, e todos os seus isótopos são radioativos.
O 99Tc é um dos produtos da fissão nuclear do urânio.
A partir dessas informações e com base nos conhecimentos de estrutura
atômica e das propriedades periódicas dos elementos químicos, é correto
afirmar:
a) O 99Tc tem configuração eletrônica diferente do 98Tc.
b) O tecnécio tem o maior raio covalente do quinto período da Tabela
Periódica.
c) A configuração dos elétrons mais externos do tecnécioé representada
por 5s2.
d) O tecnécio tem a maior densidade e o maior ponto de fusão de seu
grupo periódico.
e) A configuração eletrônica do tecnécio, em ordem crescente de energia,
é representada por [Kr]4d55s2.
11.
A forma como os átomos se unem influencia as propriedades de metais de
espécies iônicas, de moléculas, de agregados iônicos e moleculares, o que
põe em evidência a relação entre propriedades físicas e químicas de
substâncias com as ligações químicas e a natureza de interações
interpartículas. Considerando-se essas informações sobre a relação
entre as propriedades físicas e químicas com as ligações químicas, é
correto afirmar:
a) As substâncias simples alotrópicas, como o enxofre rômbico, S8, e o
fósforo branco, P4, possuem átomos unidos por ligações covalentes e
interações intermoleculares de natureza dipolo instantâneo-dipolo
induzido.](https://image.slidesharecdn.com/estaduais2014-131105133746-phpapp01/85/Estaduais2014-7-320.jpg)



