Sandrogreco Gabarito Da Lista De ExercíCios 4 Q. Org Eng. Pet. 2007
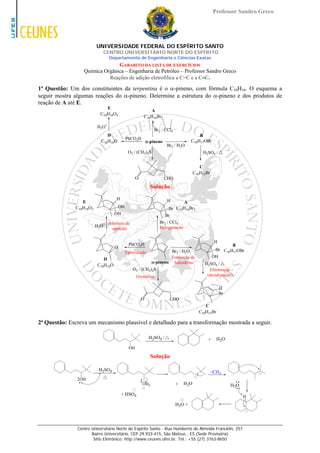
- 1. Professor Sandro Greco UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO UNIVERSITÁRIO NORTE DO ESPÍRITO Departamento de Engenharia e Ciências Exatas GABARITO DA LISTA DE EXERCÍCIOS Química Orgânica – Engenharia de Petróleo – Professor Sandro Greco Reações de adição eletrofílica a C=C e a C≡C. 1ª Questão: Um dos constituintes da terpentina é o α-pineno, com fórmula C10H16. O esquema a seguir mostra algumas reações do α-pineno. Determine a estrutura do α-pineno e dos produtos de reação de A até E. E A C10H18O2 C10H16Br2 H3O+ Br2 / CCl4 D B PhCO3H C10H16O α-pineno C10H17OBr Br2 / H2O O3 / (CH3)2S H2SO4 / C C10H15Br O CHO Solução H H E A C10H18O2 OH Br C10H16Br2 OH Br Abertura de Br2 / CCl4 H3O+ Halogenação epóxido H PhCO3H B O Br2 / H2O Br C10H17OBr Epoxidação Formação de OH D α-pineno haloidrina H2SO4 / C10H16O O3 / (CH3)2S Eliminação Ozonólise (desidratação) H Br O CHO C C10H15Br 2ª Questão: Escreva um mecanismo plausível e detalhado para a transformação mostrada a seguir. H2SO4 / + H2O OH Solução H2SO4 ~CH3 OH OH2 + H2O H2O + HSO4 H H3O + Centro Universitário Norte do Espírito Santo - Rua Humberto de Almeida Francklin, 257 Bairro Universitário, CEP 29.933-415, São Mateus - ES (Sede Provisória) Sítio Eletrônico: http://www.ceunes.ufes.br, Tel.: +55 (27) 3763-8650
- 2. Professor Sandro Greco UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO UNIVERSITÁRIO NORTE DO ESPÍRITO Departamento de Engenharia e Ciências Exatas 3ª Questão: A cloração do triariletileno forma o alceno clorado no lugar do dicloroalcano. Sugira um mecanismo e uma explicação para esse dado experimental. OCH3 OCH3 OCH3 Cl2 OCH3 H3CO H3CO Cl Solução – A primeira reação certamente é uma adição eletrofílica de cloro. Uma possibilidade de mecanismo é a formação do dicloreto vicinal via adição eletrofílica de cloro seguida por uma eliminação de primeira ordem para formar um cátion extremamente estável por ser terciário e duplamente benzílico. Outra possibilidade é a reação ocorrer via formação direta do cátion através da adição de cloro ao alceno muito reativo e assimétrico em vez do intermediário cíclico de três membros. OCH3 OCH3 OCH3 OCH3 Cl2 OCH3 OCH 3 H3CO H3CO H3CO H Cl Cl Cl OU Cl Cl E1 OCH3 OCH3 OCH3 OCH3 OCH3 OCH3 H3CO H3CO Cl H3CO H Cl Cl 4ª Questão: A reação de oximercuração-redução do limoneno ocorre em somente uma das duas duplas ligações. Providencie uma explicação para essa seletividade. 1) Hg(OAc)2 / H2O / THF 2) NaBH4 / NaOH / H2O OH CH3 Limoneno 70% Solução – Na reação de oximercuração o eletrófilo é o cátion acetato mercúrico impedido estericamente. Sendo assim, a adição eletrofílica irá ocorrer na dupla ligação menos impedida estericamente, que é a dupla exocílica. 5ª Questão: Lactonas podem ser formadas a partir de um íon halônio, proveniente de uma adição eletrofílica. Essa reação é chamada de iodolactonização. Proponha um mecanismo para a reação a seguir, mostrando a estereoquímica do produto. O I2, NaHCO3 O OH O I Solução – A primeira etapa da reação é a adição eletrofílica de iodo à dupla ligação para formar o intermediário cíclico iodônio. Posteriormente ocorrerá uma reação ácido-base entre a carboxila do Centro Universitário Norte do Espírito Santo - Rua Humberto de Almeida Francklin, 257 Bairro Universitário, CEP 29.933-415, São Mateus - ES (Sede Provisória) Sítio Eletrônico: http://www.ceunes.ufes.br, Tel.: +55 (27) 3763-8650
- 3. Professor Sandro Greco UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO UNIVERSITÁRIO NORTE DO ESPÍRITO Departamento de Engenharia e Ciências Exatas ácido carboxílico e o bicarbonato de sódio para formar o carboxilato de sódio que irá reagir com o iodônio abrindo o sistema cíclico e formando a lactona. O O O OH O H Na[HCO3] O Na O I I I O I I + H2CO3 6ª Questão: Dois produtos são formados a partir da reação do p-metoxi-alilbenzeno com cloro, como mostra a equação a seguir. Proponha um mecanismo que explique a formação de B. A substituição do grupamento 4-metoxifenil pelo grupo 4-clorofenil influencia na formação de B? Explique a sua resposta. Cl Cl Cl2 + Cl Cl H3CO H3CO A H3CO B Solução – A primeira etapa da reação é a adição eletrofílica de cloro à dupla ligação para formar o intermediário cíclico clorônio. O produto A será formado após o ataque do íon cloreto ao intermediário clorônio. Já para a formação do produto B, antes do ataque nucleofílico do íon cloreto ocorrerá um rearranjo do intermediário clorônio assistido pelo anel aromático para formar o íon arênio, como mostra o esquema abaixo. O grupo p-metoxila é um doador de elétrons altamente eficiente por conjugação, o que favorece a formação do íon arênio com um tempo de meia-vida suficientemente longo para adquirir a sua conformação final e sofrer o ataque nucleofílico. Dessa forma, a troca do grupo p-metoxila por p-cloro irá prejudicar a formação do íon arênio visto que o cloro é um átomo atrator de elétrons por efeito indutivo, consequentemente dificultando a formação do produto B. íon arênio OCH3 OCH3 OCH3 OCH3 OCH3 OCH3 e/ou Cl Cl Cl Cl Cl Cl Cl OCH3 Cl Cl Cl Cl Cl H3CO B A H3CO H3CO Cl Cl Cl 7ª Questão: A síntese do sesquiterpeno farnesol requer a conversão de um composto diclorado em um alquinol, como mostrado abaixo. Sugira um modo de fazer estas transformações. Cl Cl OH ? ? OH farnesol Solução – A primeira etapa da síntese é uma reação de eliminação dupla do dicloro-alcano para produzir um alquino terminal, para tal usa-se dois mols de uma base forte, em geral NaNH2 em NH3 líquida como solvente. Uma vez formado o alquino terminal, que possui um hidrogênio com certa acidez (pKa ≅ 25), esse irá ser desprotonado para formar o respectivo ânion que posteriormente irá Centro Universitário Norte do Espírito Santo - Rua Humberto de Almeida Francklin, 257 Bairro Universitário, CEP 29.933-415, São Mateus - ES (Sede Provisória) Sítio Eletrônico: http://www.ceunes.ufes.br, Tel.: +55 (27) 3763-8650
- 4. Professor Sandro Greco UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO UNIVERSITÁRIO NORTE DO ESPÍRITO Departamento de Engenharia e Ciências Exatas reagir com o iodo-metanol via um mecanismo SN2 para gerar o intermediário. A etapa seguinte é uma redução via metal para produzir um alceno trans. Cl Cl 1) NaNH / NH líquida 2 3 OH Nao / NH3 líquida farnesol 2) ICH2OH t-BuOH 8ª Questão: Providencie mecanismos factíveis para as etapas indicadas na síntese abaixo e explique qualquer regio e estereosseletividade apresentada. HO OH O AMCPB O HF O O H3O O O O O OH Mercanismo Mercanismo F H3O NaOH (aq.) O Mercanismo O OH F F Solução – A epoxidação ocorre pela face de baixo do anel devido ao grupo metila bloquear a face de cima do alceno. A abertura do epóxido com o HF forma o produto trans diaxial. Posteriormente ocorre uma eliminação para formar a enona por um mecanismo E1cB. O grupo hidroxila (-OH) está numa posição axial e, portanto pode ser facilmente perdido. F F O O O O O H F O O O O O OH O H Cl = O O H H3O O AMCPB O O O HO OH F HO H F F E1cB O HO F 9ª Questão: Um artigo científico publicado na revista The Journal of Organic Chemistry reportou uma surpreendente seletividade na epoxidação da olefina ilustrada a seguir. Nessa reação, a olefina B em 1 mostrou-se muito menos reativa do que a olefina A. Usando os conhecimentos de efeitos estereoeletrônicos, explique a menor reatividade da olefina B que desfavorece a síntese de 3. Solução – O orbital σ antiligante (σ*) C-Cl é bem posicionado para interagir com o orbital π ligante C-C. Essa interação estabilizadora deverá reduzir a nucleofilicidade da dupla ligação. O esquema abaixo mostra a interação π C-C → σ* C-Cl. Centro Universitário Norte do Espírito Santo - Rua Humberto de Almeida Francklin, 257 Bairro Universitário, CEP 29.933-415, São Mateus - ES (Sede Provisória) Sítio Eletrônico: http://www.ceunes.ufes.br, Tel.: +55 (27) 3763-8650
- 5. Professor Sandro Greco UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO UNIVERSITÁRIO NORTE DO ESPÍRITO Departamento de Engenharia e Ciências Exatas 10ª Questão: Proponha o mecanismo para a reação mostrada abaixo explicando a estereoquímica do produto final. Solução – Inicialmente o alceno ataca o IBr deslocando o brometo e formando o intermediário cíclico iodônio. Em seguida, o átomo de oxigênio da carbonila no carbonato faz um ataque intramolecular a um dos carbonos do iodônio, resultando no deslocamento do íon. O cátion terc-butila é perdido e trapeado pelo ânion brometo formando o carbonato cíclico. CH3 CH3 Et CH3 CH3 Et CH3 CH3 Et TBSO TBSO + I Br TBSO + Br I O O O O I O O O O O CH3 CH3 Et CH3 CH3 Et Br + TBSO I TBSO I O O O O O O Centro Universitário Norte do Espírito Santo - Rua Humberto de Almeida Francklin, 257 Bairro Universitário, CEP 29.933-415, São Mateus - ES (Sede Provisória) Sítio Eletrônico: http://www.ceunes.ufes.br, Tel.: +55 (27) 3763-8650
