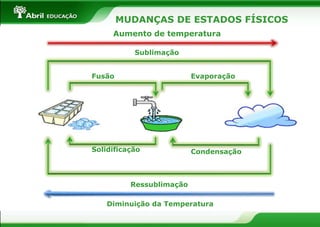
O documento discute as propriedades da matéria e sua estrutura a nível atômico. Apresenta os três estados físicos da matéria - sólido, líquido e gasoso - e as mudanças entre eles causadas por variações de temperatura. Também resume os principais modelos atômicos desenvolvidos por cientistas como Dalton, Rutherford, Thomson e Bohr para explicar a estrutura interna dos átomos.