Termodinâmica conceitos básicos
- 2. Capítulo – 1 - Termodinâmica Aplicada - pág - 2 1 - CONCEITOS FUNDAMENTAIS 1.1 - Sistema Termodinâmico Sistema termodinâmico consiste em uma quantidade de matéria ou região para a qual nossa atenção está voltada. Demarcamos um sistema termodinâmico em função daquilo que desejamos calcular. Tudo que se situa fora do sistema termodinâmico é chamado MEIO ou VIZINHANÇA. O sistema termodinâmico a ser estudado é demarcado através de uma FRONTEIRA ou SUPERFÍCIE DE CONTROLE a qual pode ser móvel, fixa, real ou imaginária. Sistema Fechado - É o sistema termodinâmico no qual não há fluxo de massa através das fronteiras que definem o sistema. Volume de Controle - Ao contrário do sistema fechado, é o sistema termodinâmico no qual ocorre fluxo de massa através da superfície de controle que define o sistema. Assim, dependendo da interação entre o sistema termodinâmico definido para estudo, e a vizinhança, chamaremos a essa região de Sistema Fechado (demarcado pela fronteira) ou Volume de Controle (demarcado pela superfície de controle) conforme se verifique as definições acima citadas. Exemplos de Sistema Fechado e Volume de Controle A figura 1.1-1 é um sistema termodinâmico fechado, pois não há fluxo de massa através das fronteiras do sistema, embora haja fluxo de calor. A figura 1.1-2, por sua vez, constitui um volume de controle pois temos fluxo de massa atravessando a superfície de controle do sistema. Fig. 1.1-1 - Sistema fechado Fig. 1 .1-2 - Volume de controle Sistema Isolado - Dizemos que um sistema termodinâmico é isolado quando não existe qualquer interação entre o sistema termodinâmico e a sua vizinhança. (ou seja, através das fronteiras não ocorre fluxo de calor, massa, trabalho etc. ) 2
- 3. Capítulo – 1 - Termodinâmica Aplicada - pág - 3 1.2 - Estado e Propriedades de uma Substância Se considerarmos uma massa de água, reconhecemos que ela pode existir sob várias formas. Se é inicialmente líquida pode-se tornar vapor após aquecida ou sólida quando resfriada. Assim nos referimos às diferentes fases de uma substância: uma fase é definida como uma quantidade de matéria totalmente homogênea; quando mais de uma fase está presente, as fases se acham separadas entre si por meio dos contornos das fases. Em cada fase a substância pode existir a várias pressões e temperaturas ou, usando a terminologia da termodinâmica, em vários estados. O estado pode ser identificado ou descrito por certas propriedades macroscópicas observáveis; algumas das mais familiares são: temperatura, pressão, volume, etc. Cada uma das propriedades de uma substância num dado estado tem somente um valor definido e essa propriedade tem sempre o mesmo valor para um dado estado, independente da forma pela qual a substância chegou a ele. De fato, uma propriedade pode ser definida como uma quantidade que depende do estado do sistema e é independente do caminho (isto é, da história) pelo qual o sistema chegou ao estado considerado. Inversamente, o estado é especificado ou descrito pelas propriedades. Propriedades Termodinâmicas - As propriedades termodinâmicas podem ser divididas em duas classes gerais, as intensivas e as extensivas. Propriedade Extensiva - Chamamos de propriedade extensiva àquela que depende do tamanho (extensão) do sistema ou volume de controle. Assim, se subdividirmos um sistema em várias partes (reais ou imaginárias) e se o valor de uma dada propriedade for igual à soma das propriedades das partes, esta é uma variável extensiva. Por exemplo: Volume, Massa, etc. Propriedade Intensiva - Ao contrário da propriedade extensiva, a propriedade intensiva, independe do tamanho do sistema. Exemplo: Temperatura, Pressão etc. Propriedade Específica - Uma propriedade específica de uma dada substância é obtida dividindo-se uma propriedade extensiva pela massa da respectiva substância contida no sistema. Uma propriedade específica é também uma propriedade intensiva do sistema. Exemplo de propriedade específica: Volume específico , νν , νν == V M Energia Interna específica , u, u U M == onde: M é a massa do sistema, V o respectivo volume e U é a energia interna total do sistema. 3
- 4. Capítulo – 1 - Termodinâmica Aplicada - pág - 4 1.3 - Mudança de Estado de um Sistema Termodinâmico Quando qualquer propriedade do sistema é alterada, por exemplo; Pressão, Temperatura, Massa, Volume, etc. dizemos que houve uma mudança de estado no sistema termodinâmico. Processo - O caminho definido pela sucessão de estados através dos quais o sistema passa é chamado processo. Exemplos de processos: - Processo Isobárico (pressão constante) - Processo Isotérmico (temperatura constante) - Processo Isocórico (isométrico) (volume constante) - Processo Isoentálpico (entalpia constante) - Processo Isoentrópico (entropia constante) - Processo Adiabático (sem transferência de calor) Ciclo Termodinâmico - Quando um sistema (substância), em um dado estado inicial, passa por certo número de mudança de estados ou processos e finalmente retorna ao estado inicial, o sistema executa um ciclo termodinâmico. Deve ser feita uma distinção entre ciclo termodinâmico, descrito acima, e um ciclo mecânico. Um motor de combustão interna de quatro tempos executa um ciclo mecânico a cada duas rotações. Entretanto o fluido de trabalho não percorreu um ciclo termodinâmico dentro do motor, uma vez que o ar e o combustível são queimados e transformados nos produtos de combustão, que são descarregados para a atmosfera. 1.4 - Lei Zero da Termodinâmica Quando dois corpos tem a mesma temperatura dizemos que estão em equilíbrio térmico entre si. Podemos definir a lei zero da termodinâmica como: " Se dois corpos estão em equilíbrio térmico com um terceiro eles estão em equilibrio térmico entre si ". A lei zero da termodinâmica define os medidores de temperatura, os TERMÔMETROS. 4
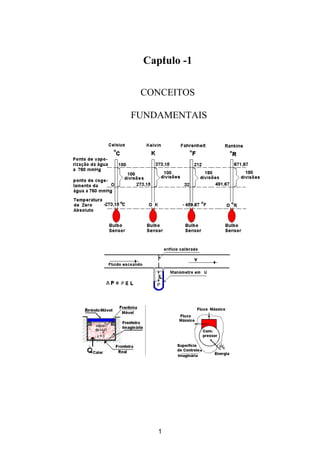
- 5. Capítulo – 1 - Termodinâmica Aplicada - pág - 5 1.5 - Escalas de Temperatura Para a maior parte das pessoas a temperatura é um conceito intuitivo baseado nas sensações de "quente" e "frio" proveniente do tato. De acordo com a segunda lei da termodinâmica, a temperatura está relacionada com o calor ficando estabelecido que este, na ausência de outros efeitos, flui do corpo de temperatura mais alta para o de temperatura mais baixa espontaneamente. O funcionamento dos termômetros está baseada na lei zero da termodinâmica pois são colocados em contato com um corpo ou fluido do qual se deseja conhecer a temperatura até que este entre em equilíbrio térmico com o respectivo corpo. A escala do aparelho foi construída comparando-a com um termômetro padrão ou com pontos físicos fixos de determinadas substâncias. Quatro escalas de temperatura são hoje usadas para se referir àtemperatura, duas escalas absolutas e duas escalas relativas; são elas respectivamente: Escala KELVIN (K) e RANKINE (°R) e escala Celsius (°C) e Fahrenheit (°F). A Fig. 1.5-1 mostra as quatro escalas de temperatura e a relação entre elas. Figura 1.5-1 - As escalas de temperatura e sua inter-relação Tipos de Termômetros - Termômetro de Mercúrio em vidro (expansão volumétrica) - Termômetro de Alcool em vidro (expansão volumétrica) - Termômetro de Par Bimetálico (dilatação linear diferenciada) - Termômetro de Termistores (variação da resistividade) - Termômetro de Gás Perfeito (expansão volumétrica) - Termômetro de Termopar (força eletromotriz) - Pirômetro Ótico (cor da chama) - etc. 5
- 6. Capítulo – 1 - Termodinâmica Aplicada - pág - 6 Exemplo 1.5-1 Escreva a relação entre graus Celsius (o C) e Fahrenheit (o F) Solução - Considere-se a escala dos dois Termômetros, Celsius e Fahrenheit como mostrado na figura Interpolando linearmente as escalas entre a referência de gelo fundente e a referência de vaporização da água temos: O O C F−− −− == −− −− 0 100 0 32 212 32 → O O C F== −− 5 9 32( ) 1.6 - Pressão Pressão, uma propriedade termodinâmica, é definida como sendo a relação entre uma força e a área normal onde está sendo aplicada a força. A Fig. 1.6-1 ilustra a definição dada pela equação 1.6 -1 P A A F A i N == →→ lim δδ δδ δδ δδ (1.6 -1) Figura 1.6-1 - Definição de Pressão 6
- 7. Capítulo – 1 - Termodinâmica Aplicada - pág - 7 Unidades de Pressão Pascal, Pa = N m2 , Quilograma - força por metro quadrado, = kgf m2 Psig = lbf in2 , (manométrica) Psia = lbf in2 (absoluta) bar = 10 5 Pascal As pressões abaixo da pressão atmosférica e ligeiramente acima e as diferenças de pressão (como por exemplo, ao longo de um tubo, medidas através de um orifício calibrado) são obtidas freqüentemente com um manômetro em U que contém como fluido manométrico: água, mercúrio, Alcool, etc. como mostra a Fig. 1.6-2 Figura 1.6-2 manômetro em U usado junto com um orifício calibrado Pelos princípios da hidrostática podemos concluir que, para uma diferença de nível, L em metros, em um manômetro em U, a diferença de pressão em Pascal é dada pela relação : ∆∆P gL== ρρ onde g é a aceleração da gravidade, em m/s 2 , ρρ é a densidade do fluido manométrico, em kg/m 3 e L é a altura da coluna de líquido, em m (metros) . OBS. A pressão atmosférica padrão é definida como a pressão produzida por uma coluna de mercúrio exatamente igual a 760 mm sendo a densidade do mercúrio de 13,5951 gm / cm 3 sob a aceleração da gravidade padrão de 9,80665 m / s 2 uma atmosfera padrão = 760 mmHg =101325 Pascal = 14,6959 lbf / in 2 7
- 8. Capítulo – 1 - Termodinâmica Aplicada - pág - 8 Exemplo 1.6-1 Em uma análise para se obter o balanço térmico de um motor diesel é necessário medir-se a vazão de ar admitido pelo motor. Um orifício calibrado é montado em uma caixa de entrada junto com um manômetro em U na admissão do motor, como mostrado, esquematicamente na figura. A vazão mássica do fluido escoando, m •• , em kg/m3 está relacionada, em um orifício calibrado, pela seguinte expressão, m AC PD •• == 2ρρ ∆∆ , onde ∆∆P é a diferença de pressão no manômetro em U , em Pascal, A é a área do orifício calibrado, em metros quadrados, CD é o coeficiente de descarga do orifício, cujo valor particular, para este caso é 0,59, ρρ é a densidade do fluido em escoamento. Determinar a vazão de ar para os dados mostrados na figura. (Considere a aceleração gravitacional local igual a 9,81 m/s2 , a densidade do ar como sendo, ρρ = 1,2 kg/m3 e a densidade da água do manômetro igual a 1000 kg/m3 ) Solução - Cálculo da diferença de Pressão indicada no manômetro em U: ∆∆P g L Pa== == •• •• ==ρρ 1000 9 81 0 260 2550 6, , , - Calculo da área do orifício calibrado. Dos dados da figura temos A d m== == •• == ππ 2 2 2 4 314159 0 045 4 0 00159 , ( , ) , - A vazão em massa de ar admitida pelo motor diesel, pela expressão será m kg s AR •• == •• •• •• ==0 00159 0 59 2 1 2 2550 6 0 0734, , , . , , 8
- 9. Capítulo – 1 - Termodinâmica Aplicada - pág - 9 Exercícios 1-1) Um manômetro montado em um recipiente indica uma pressão de 1,25MPa e um barômetro local indica 96kPa. Determinar a pressão interna absoluta do recipiente em: a) MPa , b) kgf/cm 2 , c) Psia e d) em milímetros de coluna de mercúrio. OBS.: Adote para o mercúrio a densidade de 13,6gm/cm 3 1-2) Um termômetro, de liquido em vidro, indica uma temperatura de 30 o C. Determine a respectiva temperatura nas seguintes escalas: a) em graus Fahrenheit ( o F) , b) em graus Rankine ( o R) e c) em Kelvin (K). 1-3) Um manômetro contém um fluido com densidade de 816 kg/m 3 . A diferença de altura entre as duas colunas é 50 cm. Que diferença de pressão é indicada em kgf/cm 2 ? Qual seria a diferença de altura se a mesma diferença de pressão fosse medida por um manômetro contendo mercúrio (adote densidade do mercúrio de 13,60 gm/cm 3 ) 1-4) Um manômetro de mercúrio, usado para medir um vácuo, registra 731 mm Hg e o barômetro local registra 750 mm Hg. Determinar a pressão em kgf/cm 2 e em microns. 9
- 11. Capítulo - 2 - Termodinâmica Aplicada - pág. - 2 2 - PROPRIEDADES DE UMA SUBSTÂNCIA PURA 2.1 - Substância Pura Substância pura é aquela que tem composição química invariável e homogênea. Pode existir em mais de uma fase, mas a sua composição química é a mesma em todas as fases. Assim água líquida e vapor d'água ou uma mistura de gelo e água líquida são todas substância puras, pois cada fase tem a mesma composição química. Por outro lado uma mistura de ar líquido e gasoso não é uma substância pura, pois a composição química da fase líquida é diferente daquela da fase gasosa. Neste trabalho daremos ênfase àquelas substâncias que podem ser chamadas de substância simples compressíveis. Por isso entendemos que efeitos de superfície, magnéticos e elétricos, não são significativos quando se trata com essas substâncias. Equilíbrio de Fase Líquido - Vapor - Considere-se como sistema 1 kg de água contida no conjunto êmbolo-cilindro como mostra a figura 2.1-1. Suponha que o peso do êmbolo e a pressão atmosférica local mantenham a pressão do sistema em 1,014 bar e que a temperatura inicial da água seja de 15 O C. À medida que se transfere calor para a água a temperatura aumenta consideravelmente e o volume específico aumenta ligeiramente (Fig. 2.1-1b) enquanto a pressão permanece constante. Figura 2.1-1 - Representação da terminologia usada para uma substância pura à pressão P e temperatura T, onde Tsat é a temperatura de saturação na pressão de saturação P. Quando a água atinge 100 O C uma transferência adicional de calor implica em uma mudança de fase como mostrado na Fig. 2.1-1b para a Fig. 2.1-1c, isto é, 11
- 12. Capítulo - 2 - Termodinâmica Aplicada - pág. - 3 uma parte do líquido torna-se vapor e, durante este processo, a pressão permanecendo constante, a temperatura também permanecerá constante mas a quantidade de vapor gerada aumenta consideravelmente (aumentado o volume específico), como mostra a Fig. 2.1-1c. Quando a última porção de líquido tiver vaporizado (Fig. 2.1-1d) uma adicional transferência de calor resulta em um aumento da temperatura e do volume específico como mostrado na Fig. 2.1-1e e Fig. 2.1-1f Temperatura de saturação - O termo designa a temperatura na qual se dá a vaporização de uma substância pura a uma dada pressão. Essa pressão é chamada “pressão de saturação” para a temperatura dada. Assim, para a água (estamos usando como exemplo a água para facilitar o entendimento da definição dada acima) a 100 o C, a pressão de saturação é de 1,014 bar, e para a água a 1,014 bar de pressão, a temperatura de saturação é de 100 o C. Para uma substância pura há uma relação definida entre a pressão de saturação e a temperatura de saturação correspondente. Líquido Saturado - Se uma substância se encontra como líquido à temperatura e pressão de saturação diz-se que ela está no estado de líquido saturado, Fig.2.1-1b. Líquido Subresfriado - Se a temperatura do líquido é menor que a temperatura de saturação para a pressão existente, o líquido é chamado de líquido sub-resfriado (significa que a temperatura é mais baixa que a temperatura de saturação para a pressão dada), ou líquido comprimido, Fig. 2.1-1a, (significando ser a pressão maior que a pressão de saturação para a temperatura dada). Título (x) - Quando uma substância se encontra parte líquida e parte vapor, vapor úmido, Fig. 2.1-1c, a relação entre a massa de vapor pela massa total, isto é, massa de líquido mais a massa de vapor, é chamada título. Matematicamente: x m m m m m v l v v t = + = (2.1-1) Vapor Saturado - Se uma substância se encontra completamente como vapor na temperatura de saturação, é chamada “vapor saturado”, Fig. 2.1-1d, e neste caso o título é igual a 1 ou 100% pois a massa total (mt) é igual àmassa de vapor (mv), (freqüentemente usa-se o termo “vapor saturado seco”) Vapor Superaquecido - Quando o vapor está a uma temperatura maior que a temperatura de saturação é chamado “vapor superaquecido” Fig. 2.1-1e. A pressão e a temperatura do vapor superaquecido são propriedades independentes, e neste caso, a temperatura pode ser aumentada para uma pressão constante. Em verdade, as substâncias que chamamos de gases são vapores altamente superaquecidos. A Fig. 2.1-1 retrata a terminologia que acabamos de definir para os diversos estados termodinâmicos em que se pode encontrar uma substância pura. 12
- 13. Capítulo - 2 - Termodinâmica Aplicada - pág. - 4 Considerações importantes 1) Durante a mudança de fase de líquido-vapor à pressão constante, a temperatura se mantém constante; observamos assim a formação de patamares de mudança de fase em um diagrama de propriedades no plano T x v ou P x v, como mostrado na Fig. 2.2-1. Quanto maior a pressão na qual ocorre a mudança de Fase líquido-vapor maior será a temperatura. 2) Aumentando-se a pressão observa-se no diagrama que as linhas de líquido saturado e vapor saturado se encontram. O ponto de encontro dessas duas linhas define o chamado "Ponto Crítico". Pressões mais elevadas que a pressão do ponto crítico resultam em mudança de fase de líquido para vapor superaquecido sem a formação de vapor úmido. Figura 2.2-1 diagrama T x v e diagrama P x v 3) A linha de líquido saturado é levemente inclinada em relação à vertical pelo efeito da dilatação volumétrica (quanto maior a temperatura maior o volume ocupado pelo líquido), enquanto a linha de vapor saturado é fortemente inclinada em sentido contrário devido àcompressibilidade do vapor. A Fig. 2.2-1b mostra o diagrama P -V no qual é fácil visualizar as linhas de temperatura constante e o ponto de inflexão da isoterma crítica Como exemplo, o ponto crítico para a água, é: Pcrítica = 22,09 MPa Tcrítica = 374,14 O C Vcritico = 0,003155 m3 / kg Ponto Triplo - Corresponde ao estado no qual as três fases (sólido, líquido e gasosa) se encontram em equilíbrio. A Fig. 2.3-1 mostra um diagrama de fases (P x T). Para qualquer outra substância o formato do diagrama é o mesmo. 13
- 14. Capítulo - 2 - Termodinâmica Aplicada - pág. - 5 Uma substância na fase vapor com pressão acima da pressão do ponto triplo muda de fase (torna-se líquido) ao ser resfriada até a temperatura correspondente na curva de pressão de vapor. Resfriando o sistema ainda mais será atingida uma temperatura na qual o líquido irá se solidificar. Este processo está indicado pela linha horizontal 1→2→3 na Fig. 2.3-1. Para uma substância na fase sólida com pressão abaixo da pressão do ponto triplo ao ser aquecida observe que, mantendo a pressão constante, será atingida uma temperatura na qual ela passa da fase sólida diretamente para a fase vapor, sem passar pela fase líquida, como mostrado na Fig. 2.3-1 no processo 4→5. Como exemplo a pressão e a temperatura do ponto triplo para a água corresponde a 0,6113 kPa e 0,01 O C respectivamente. Figura 2.3-1 Diagrama de fases para a água (sem escala) 2.2 - Propriedades Independentes das Substâncias Puras Uma propriedade de uma substância é qualquer característica observável dessa substância. Um número suficiente de propriedades termodinâmicas independentes constituem uma definição completa do estado da substância. As propriedades termodinâmicas mais comuns são: temperatura (T), pressão (P), e volume específico (v) ou massa específica (ρ). Além destas propriedades termodinâmicas mais familiares, e que são diretamente mensuráveis , existem outras propriedades termodinâmicas fundamentais usadas na análise de transferência de energia (calor e trabalho), não mensuráveis diretamente, que são: energia interna específica (u), entalpia específica (h) e entropia específica (s). Energia Interna (U) - é a energia possuída pela matéria devido ao movimento e/ou forças intermoleculares. Esta forma de energia pode ser decomposta em duas partes: a - Energia cinética interna, a qual é devida àvelocidade das moléculas e, b - Energia potencial interna, a qual é devida às forças de atração que existem entre as moléculas. As mudanças na velocidade das moléculas são identificadas macroscopicamente pela alteração da temperatura da substância (sistema), enquanto que as variações na posição são identificadas pela mudança de fase da substância (sólido, liquido ou vapor) Entalpia (H) - na análise térmica de alguns processos específicos, freqüentemente encontramos certas combinações de propriedades termodinâmicas. Uma dessas combinações ocorre quando temos um processo a 14
- 15. Capítulo - 2 - Termodinâmica Aplicada - pág. - 6 pressão constante, resultando sempre uma combinação (U + PV). Assim considerou-se conveniente definir uma nova propriedade termodinâmica chamada “ENTALPIA”, representada pela letra H, determinada matematicamente pela relação: H = U + P V (2.2-1) ou a entalpia específica, h = u + P ν (2.2-2) Entropia (S) - Esta propriedade termodinâmica representa, segundo alguns autores, uma medida da desordem molecular da substância ou, segundo outros, a medida da probabilidade de ocorrência de um dado estado da substância. Matematicamente a definição de entropia é dS Q T reversivel == δδ (2.2-3) 2.3 - Equações de Estado Equação de estado de uma substância pura é uma relação matemática que correlaciona pressão temperatura e volume específico para um sistema em equilíbrio termodinâmico. De uma maneira geral podemos expressar de forma genérica essa relação na forma da Eq. (2.3-1) f(P, v, T) = 0 (2.3 -1) Existem inúmeras equações de estado, muitas delas desenvolvidas para relacionar as propriedades termodinâmicas para uma única substância , outras mais genéricas, por vezes bastante complexas, com objetivo de relacionar as propriedades termodinâmicas de várias substâncias. Uma das equações de estado mais conhecida e mais simples é aquela que relaciona as propriedades termodinâmicas de pressão, volume específico e temperatura absoluta do gás ideal, que é; P Tνν _ == ℜℜ (2.3-2) onde P, é a pressão absoluta (manométrica + barométrica), em Pascal, νν _ , o volume molar específico, em m3 /kmol, a constante universal do gás, que vale, ℜℜ = 8,314 kJ/kmol-K, e T a temperatura absoluta, em Kelvin. A Eq. (2.3-2) pode ser escrita de várias outras formas. Uma forma interessante é escreve-la usando o volume específico e a constante particular do gás, como na Eq. (2.3-3) P RTνν == (2.3-3) onde νν , é o volume específico do gás, em m3 /kg e R é a constante particular do gás. O valor de R está relacionado à constante universal dos gases pela massa molecular da substância (M). Isto é: 15
- 16. Capítulo - 2 - Termodinâmica Aplicada - pág. - 7 R M == ℜℜ (2.3-4) Como sabemos, a Eq. (2.3-2) ou (2.3-3) só representa satisfatoriamente gases reais a baixas pressões. Para gases reais a pressões um pouco mais elevadas e gases poliatômicos os resultados obtidos com a equação do gás ideal não é satisfatório, sendo necessário, para gás real, lançar mão de equações mais elaboradas. Exemplo 2.3-1 Considere o ar atmosférico como um gás ideal e determine o volume específico e a densidade para a pressão atmosférica padrão na temperatura de 20 o C. (adote a massa molecular do ar = 28,97 kg/kmol , ℜℜ = 8 314 J/ kmol-K) Solução Para a hipótese de gás ideal temos: P v RT v RT P == ⇒⇒ == A constante particular do gás é dada por: R M == ℜℜ ⇒⇒ R == ⇒⇒ 8314 28 97, R J kg Ka r ≅≅ •• 287 logo, o volume específico será a) v m kg == ++ ≅≅ 287 27315 20 101325 0 8303 3 . ( , ) , A densidade é o inverso do volume específico, assim; b) ρρ == == == 1 1 0 8303 1 204 3 v kg m, , A equação de estado para gás real mais antiga é a equação de van der Waals (1873) e foi apresentada como uma melhoria semi-teórica da equação de gases ideais, que na forma molar é; P T b a == ℜℜ −− −− νν νν _ _ 2 (2.3-5) 16
- 17. Capítulo - 2 - Termodinâmica Aplicada - pág. - 8 O objetivo da constante "b" na equação é corrigir o volume ocupado pelas moléculas e o termo " a / νν _ 2 " é uma correlação que leva em conta as forças intermoleculares de atração das moléculas. As constantes "a " e "b " são calculadas a partir do comportamento do gás. Estas constantes são obtidas observando-se que a isoterma crítica (Fig. 2.2b) tem um ponto de inflexão no ponto crítico e portanto nesse ponto a inclinação é nula [2] Os valores das constantes " a " e " b " são determinados em função das propriedades do ponto crítico, pressão crítica , PC, e temperatura crítica, TC, para cada gás. a T P C C == ℜℜ27 64 2 2 , b T P C C == ℜℜ 8 (2.3-6) Uma outra equação, considerada mais precisa que a equação de van der Waals e com o mesmo nível de dificuldade é a equação de Redlich - kwong (1949), que para propriedades molares é: P T b a b T == ℜℜ −− −− ++νν νν νν _ _ _ ( ) 1 2 (2.3-7) Esta equação é de natureza empírica, as constantes "a " e " b " valem; a T P C 0 4278 2 5 2 , , b T P C C == ℜℜ 0 08664, (2.3-8) Constantes para as equações de estado de van der Waals e de Redlich- Kwong para algumas substâncias são dadas na tabela 2.3 -1. As constantes dadas na tabela (2.3-1) são para pressão, P, em bar, volume específico molar, νν _ , em m3 / kmol e temperatura, T, em Kelvin 17
- 18. Capítulo - 2 - Termodinâmica Aplicada - pág. - 9 Tabela (2.3-1) van der Waals Redlich - Kwong Substâncias a bar m kmol , ( ) 3 2 b m kmol , 3 a bar m kmol K, ( ) , 3 2 0 5 b m kmol , 3 Ar 1,368 0,0367 15,989 0,02541 Butano (C4H10) 13,860 0,1162 289,55 0,08060 Dióxido de carbono (CO2) 3,647 0,0428 64,43 0,02963 Monóxido de carbono (CO) 1,474 0,0395 17,22 0,02737 Metano (CH4) 2,293 0,0428 32,11 0,02965 Nitrogênio (N2) 1,366 0,0386 15,53 0,02677 Oxigênio (O2) 1,369 0,0317 17,22 0,02197 Propano (C3H8) 9,349 0,0901 182,23 0,06342 Refrigerante 12 10,490 0,0971 208,59 0,06731 Dióxido Sulfúrico (SO2) 6,883 0,0569 144,80 0,03945 Vapor Água (H2O) 5,531 0,0305 142,59 0,02111 Exemplo 2.3-2 Um tanque cilíndrico vertical contém 4,0 kg de monóxido de carbono gás à temperatura de -50 O C. O diâmetro interno do tanque é, D=0,2 m e o comprimento, L=1,0 m. Determinar a pressão, em bar, exercida pelo gás usando: a) O modelo de gás ideal, b) O modelo de van der Waals e c) O modelo de Redlich - Kwong Solução Conhecemos: Tanque cilíndrico de dimensões conhecidas contendo 4,0 kg de monóxido de carbono, CO, a - 50 O C Determinar: A pressão exercida pelo gás usando três modelos diferentes. Hipóteses: 1) Como mostrado na figura ao lado o gás é adotado como sistema fechado 2) O sistema está em equilíbrio termodinâmico Análise: O volume molar específico do gás é necessário nos três modelos requeridos, assim V d L m== == == ππ 2 2 3 4 3 14159 0 2 1 4 0 0314 , .( , ) . , o volume molar específico será: 18
- 19. Capítulo - 2 - Termodinâmica Aplicada - pág. - 10 νν νν _ ( ) ( )( , , )( ) ,== == == ==M M V m m kmol kg kmol m kg28 0 0314 4 0 0 2198 3 3 A equação de estado para o gás ideal resulta P T P T bar Pa barνν νν _ _ ( )( , ) , ( ) ,== ℜℜ →→ == ℜℜ == −− ++ == 8314 50 27315 0 2198 10 84 415 Para a Equação de estado de van der Waals as constantes " a " e " b " podem ser lidas diretamente da tabela 2.3-1, então; a bar m kmol== 1 474 3 2 , ( ) e b m kmol== 0 0395 3 , ( ) substituindo, P T b a bar Pa bar== ℜℜ −− −− == −− ++ −− −− == νν νν _ _ ( )( , ) ( , , ) ( ) , ( , ) ,2 5 2 8314 50 27315 0 2198 0 0395 10 1 474 0 2198 72 3 Também, para a equação de estado de Redlich-Kwong da tabela 2.3-1 obtemos; a bar m K kmol == 17 22 6 2 1 2 , ( ) e b m kmol == 0 02737 3 , substituindo na respectiva equação temos; P T b a b T bar Pa == ℜℜ −− −− ++ == −− ++ −− −− νν νν νν _ _ _ ( ) ( )( , ) ( , , ) ( ) , ( , )( , )( , )1 2 1 2 8314 50 27315 0 2198 0 02737 10 17 22 0 21980 0 24717 22315 5 P = 75,2 bar Observação: Comparando os valores calculados de Pressão, a equação do modelo de gás ideal resulta em 11 % maior que a equação de van der Waals. Comparando o valor de Pressão obtido pela equação de van der Waals com dados obtidos do diagrama de compressibilidade (Shapiro [2]) este valor é 5% menor. O valor obtido pela modelo de Redlich-Kwong é 1% menor que o valor obtido no diagrama de compressibilidade. Um outro exemplo de equações de estado são as de Eq. (2.3-9) até (2.3-18) que são usada para relacionar as propriedades termodinâmicas dos refrigerantes hidrocarbonos fluorados (R-12, R-22,... etc.) [5] P RT v b = − + [ ( / ) ( ) ] ( / ) ( ( )) ( ) A B T C EXP kT T v b A B T C EXP kT T c EXP v EXP v i i i c i i c+ + − − + + + − += ∑ 2 5 6 6 6 1 α α (2.3-9) 19
- 20. Capítulo - 2 - Termodinâmica Aplicada - pág. - 11 u u G i T T G T T A kT T C EXP kT T i v b i i i i i C i c i i = + − − − + + + − − −= − = ∑ ∑0 1 4 0 5 0 1 2 5 1 1 1 1 ( ) ( ) [ ( / ) ( / ) ( )( ) ]( ) + + + + −A kT T C EXP kT T EXP v c c6 61( / ) ( / ) ( )α α (2.3-10) h u Pv= + (2.3-11) s s G T T G i T T G T T i i i i = + + − − − − + = − − ∑0 1 0 2 4 1 0 1 5 2 0 2 1 2 1 1 ln( / ) ( ) ( ) ( )( ) ( ) + −R v bln( ) − − − − − −− = ∑[ ( / ) ( / ) ( )( ) ]( ) B k T C EXP kT T i v b i C i c i i 1 1 2 5 B k T C EXP kT T EXP v c c6 6− −( / ) ( / ) ( )α α (2.3-12) ln ln ( )ln( )P F F T F T F T F T T Tsat = + + + + − −1 2 3 4 5 γ γ (2.3-13) dP dT F F F T F T F T T P sat sat = + − − − − 4 3 5 2 2 5 2 γ γln( ) (2.3-14) H T v dP dTlv lv sat= ( ) (2.3-15); s H Tlv lv = (2.3-16) ρl i i c i c c D T T D T T D T T = − + − + − = − ∑ 1 5 1 3 6 1 2 7 2 1 1 1 (2.3-17) v v vlv v l= − (2.3-18) onde Ai , Bi ,Ci ,Di , Fi , Gi ,c, k, b, γγ, αα e Tc ,são constantes que dependem da substância. Muitos outros exemplos de Eqs. de estado, algumas mais simples outras mais complexas poderiam se apresentadas. Entretanto, dado a complexidade das equações de estado para correlacionar as propriedades termodinâmicas das substâncias reais seria interessante que tivéssemos um meio mais rápido para obter tais relações. As tabelas de propriedades termodinâmicas, obtidas através das equações de estado, são as ferramentas que substituem as equações. 20
- 21. Capítulo - 2 - Termodinâmica Aplicada - pág. - 12 Exercícios 2-1) - Determine o Volume molar de um gás ideal nas condições normais de temperatura e pressão (as condições normais de temperatura e pressão, CNTP, são 0 O C e 101325 Pascal, respectivamente) 2-2) - Calcule a constante particular dos gases para o Oxigênio, Nitrogênio e para o ar seco. 2-3) - Um balão esférico tem raio de 3m. A pressão atmosférica local é de 1,0 kgf/cm2 e a temperatura é de 25 O C. a) Calcular a massa e o número de moles (ou kmoles) de ar que o balão desloca b) Se o balão estiver cheio com Hélio (He) com pressão de 1,0 kgf/cm2 e a temperatura for de 25 O C, qual o número de moles (ou kmoles) e a massa de hélio? 2-4) - Uma quantidade de ar está contida num cilindro vertical equipado com um êmbolo sem atrito, como mostrado na figura. A área seccional interna do cilindro é de 450 cm2 e o ar está inicialmente a 2,0 kgf/cm2 de pressão e temperatura de 430 O C. O ar é então resfriado como resultado da transferência de calor para o meio ambiente. (adote o ar como gás ideal) a) Qual a temperatura do ar no interior do cilindro quando o êmbolo atinge os limitadores, em O C b) Se o resfriamento prosseguir até a temperatura atingir 21 O C qual será a pressão no interior do cilindro. 2-5) - Considere 10 kg de vapor de água àtemperatura de 400 O C no interior de um vaso de pressão cujo volume é de 1,512 m3 . Determine a pressão exercida pelo vapor nestas condições. a) através da equação de gás ideal b) através da equação de van der Waals c) através da equação de Redlich-kwong d) Compare os resultados com dados da tabela de propriedades superaquecidas para o vapor de água. 21
- 22. Capítulo - 2 - Termodinâmica Aplicada - pág. - 13 2.4 - Tabelas de Propriedades Termodinâmicas Existem tabelas de propriedades termodinâmicas para todos as substâncias de interesse em engenharia. Essas tabelas são obtidas através das equações de estado, do tipo mostrado anteriormente. As tabelas de propriedades termodinâmicas estão divididas em três categorias de tabelas, uma que relaciona as propriedades do líquido comprimido (ou líquido subresfriado), outra que relaciona as propriedades de saturação (líquido saturado e vapor saturado) e as tabelas de vapor superaquecido. Em todas as tabelas as propriedades estão tabeladas em função da temperatura ou pressão e em função de ambas como pode ser visto nas tabelas a seguir. Para a região de liquido+vapor, (vapor úmido) conhecido o título, x, as propriedades devem ser determinadas através das seguintes equações: u = uL + x(uv - uL) (2.4-1) h = hL + x(hv - h L) (2.4-2) v = vL + x(vv - vL) (2.4-3) s = sL + x(sv - sL) (2.4-4) As tabelas de (2.4-1) até (2.4-12) são exemplos de tabelas de propriedades termodinâmicas de líquido comprimido, saturadas e superaquecidas de qualquer substância. Observe nessas tabelas que para condições de saturação basta conhecer apenas uma propriedade para obter as demais, que pode ser temperatura ou pressão, propriedades diretamente mensuráveis. Para as condições de vapor superaquecido e líquido comprimido é necessário conhecer duas propriedades para ser obter as demais. Nas tabelas de propriedades saturadas, aqui apresentadas, pode-se observar que para temperatura de 0,0 o C e líquido saturado (x = 0), o valor numérico de entalpia (h) é igual a 100,00 kcal/kg para os refrigerantes R-12, R-22, e R-717, sendo igual a 200,00 kJ/kg para o R- 134a, e a entropia (S), vale 1,000 para todas as tabelas dadas independente das unidades usadas. Estes valores são adotados arbitrariamente como valores de referência e os demais valores de entalpia (h) e entropia (S), são calculados em relação a esses valores de referência. Outros autores podem construir tabelas dos mesmos refrigerantes com referências diferentes. Quando as referências são diferentes, como dissemos, as propriedades têm outros valores nessas tabelas, entretanto, a diferença entre mesmos estados é igual para qualquer referência adotada. Assim, o valor numérico da entalpia (h), e entropia (S) em diferentes tabelas podem apresentar valores completamente diferentes para o mesmo estado termodinâmico, sem contudo, modificar os resultados de nossas análises térmicas, bastando para tanto que se utilize dados de entalpia e entropia de uma mesma tabela, ou de tabelas que tenham a mesma referência. Para dados retirados de duas ou mais tabelas com referências diferentes estes devem ser devidamente corrigidos para uma única referência. 22
- 23. Capítulo - 2 - Termodinâmica Aplicada - pág. - 26 Exemplo 2.4-1 a) Determine o volume específico, a energia interna específica, a entalpia específica, e a entropia específica para líquido e vapor saturado da água na pressão de saturação de 2,5 MPa. b) Determine o volume específico, a entalpia específica e a entropia específica para a água com pressão de 10 bar e temperatura de 300 O C. Solução a) Água Saturada Da tabela de propriedades da água saturada para P = 25 bar temos a correspondente temperatura de saturação, T = 224 O C As demais propriedades são: Vl = 0,001973 m3 /kg, VV = 0,0800 m3 /kg hl = 962,11 kJ/kg, hV = 2803,1 kJ/kg Ul = 959,11 kJ/kg UV = 2603,1 kJ/kg Sl = 2,5547 kJ/kg-K SV = 6,2575 kJ/kg-K] b) Água na pressão de 10 bar e Temperatura de 300 O C Da tabela de propriedades saturadas para P = 10 bar temos T = 179,9 O C. Logo, a água a 300 O C está superaquecida. Da tabela de propriedades da água superaquecida (2.4-2) temos VV = 0,2579 m3 /kg hV = 3051,2 kJ/kg SV = 7,1229 kJ/kg-K Exemplo 2.4-2 Considere um sistema composto de 2 kg de água no estado líquido à temperatura de 80 O C e pressão de 50 bar. Determine o volume específico e a entalpia para o sistema. a) através da tabela de propriedades comprimidas da água b) através da tabela de propriedades saturadas da água c) comente os desvios dos valores obtidos pelas duas formas. Solução a) Da tabela (2.4-3) de líquido comprimido para a água a 50 bar e 23
- 24. Capítulo - 2 - Termodinâmica Aplicada - pág. - 27 temperatura de 80 O C temos; (observe que a temperatura de satu- ração correspondente àpressão de 50 bar é de 263,99 O C) V = 0,0010268 m3 /kg e h = 338,85 kJ/kg b) Como podemos observar, a tabela disponível para propriedades saturadas, não tem a temperatura de 80 O C sendo necessário fazermos interpolações lineares, que resulta em: V = 0,0010291 m3 / kg e h= 334,91 kJ /kg C) Os desvios da tabela de líquido comprimido em relação àde saturação são: δνδν == −− == −− 0 0010268 0 0010291 0 0010268 100 0 22% , , , ,x δδh x== −− == 338 85 334 91 338 85 100 116% , , , , Comentários: Pelos resultados, observamos ser insignificantes os desvios dos valores das propriedades obtidas pela tabela correta (liquido comprimido) e na forma aproximada, como líquido saturado na temperatura em que se encontra a substância sem levar em conta a pressão.(a pressão de saturação a 80 O C é de 0,4739 bar, bem inferior aos 50 bar do líquido comprimido) Concluímos assim que, as propriedades de líquido comprimido são aproximadamente iguais às de líquido saturado na mesma temperatura para substâncias que podem ser admitidas como incompressíveis.(para qualquer substância incompressível) Exemplo 2.4-3 Considere um cilindro de volume interno igual a 0,14 m3 , contendo 10 kg de refrigerante R-134a. O cilindro é usado para fins de reposição de refrigerante em sistemas de refrigeração. Em um dado dia a temperatura ambiente é de 26 O C. Admita que o refrigerante dentro do cilindro está em equilíbrio térmico com o meio ambiente e determine a massa de refrigerante no estado líquido e no estado vapor no interior do cilindro. Solução: Conhecemos: tanque cilíndrico de dimensões conhecidas contendo 10 kg de refrigerante R-134a em equilíbrio térmico a 26 O C determinar: massa no estado líquido e massa no estado vapor Hipótese: 1) O gás no interior do cilindro é o sistema termodinâmico fechado 2) O sistema está em equilíbrio termodinâmico 24
- 25. Capítulo - 2 - Termodinâmica Aplicada - pág. - 28 Análise: Se no interior do cilindro tivermos de fato as duas fases: líqui- do+vapor, então o sistema está na condição de vapor úmido e podemos determinar o título, x, da mistura. O volume específico da mistura, pela definição de volume específico é: νν == == == V m m kg m kg 0140 10 0 0 014 3 3 , , , da equação (2.4-3) , que relaciona volume específico com título temos; νν νν νν νν νν νν νν νν == ++ −− →→ == −− −− l v l l v l x x( ) ( ) ( ) da tabela de propriedades saturadas para o refrigerante R-134a obtemos os valores de volume específico do líquido e do valor, que valem: νν l m kg== 0 0008 3 , νν v m kg== 0 0300 3 , substituindo na equação do título , obtemos; x == −− −− 0 0140 0 0008 0 0300 0 0008 , , , , ⇒⇒ x == 0 452, da definição de título, em que, x m m v t == , obtemos m x kgv == 0 452 10 0, , ⇒⇒ m kg de vaporv == 4 52, pela conservação de massa m m m m m m mt v l l t v l== ++ ⇒⇒ == −− ⇒⇒ == −− ⇒⇒10 0 4 52, , m kgl == 5 48, 2.5 - Diagramas de Propriedades Termodinâmicas As propriedades termodinâmicas de uma substância, além de serem apresentadas através de tabelas, são também apresentadas na forma gráfica, chamados de diagramas de propriedades termodinâmicas. Estes diagramas podem ter por ordenada e abcissa respectivamente T x ν (temperatura versus volume específico), P x h (pressão versus entalpia específica), T x s (temperatura versus entropia específica) ou ainda h x s (entalpia específica versus entropia específica). O mais conhecido desses diagramas é o diagrama h x s conhecido como diagrama de Mollier. Uma das vantagem do uso destes diagramas de propriedades é que eles apresentam numa só figura as propriedades de líquido comprimido, do vapor úmido e do vapor superaquecido como está mostrado esquematicamente nas figuras 2.5-1, 2.5-2 e 2.5-3. 25
- 26. Capítulo - 2 - Termodinâmica Aplicada - pág. - 29 Figura 2.5 - 1 - Diagrama Temperatura versus Entropia Específica Esses diagramas são úteis tanto como meio de apresentar a relação entre as propriedades termodinâmicas como porque possibilitam a visualização dos processos que ocorrem em parte do equipamento sob análise ou no todo. As três regiões características dos diagramas estão assim divididas: a) A região à esquerda da linha de liquido saturado (x=0) é a região de líquido comprimido ou líquido sub-resfriado (aqui estão os dados referentes às tabelas de líquido comprimido) b) A região compreendida entre a linha de vapor saturado (x=1) e a linha de líquido saturado (x = 0) é a região de vapor úmido. Nesta região, em geral os diagramas apresentam linhas de título constante como esquematizadas nas figuras. c) A região à direita da linha de vapor saturado seco (x = 1) é a região de vapor superaquecido. (nesta região estão os dados contidos nas tabelas de vapor superaquecido) Dado o efeito de visualização, é aconselhável, na análise dos problemas termodinâmicos, representar esquematicamente os processos em um diagrama, pois a solução torna-se clara. Assim, o completo domínio destes diagramas é essencial para o estudo dos processos térmicos. Figura 2.5 - 2 - Diagrama Entalpia Específica versus Entropia Específica 26
- 27. Capítulo - 2 - Termodinâmica Aplicada - pág. - 30 Figura 2.5 - 3 - Diagrama Pressão versus Entalpia Específica As figuras 2.5-4 e 2.5-5 a seguir, são diagramas de Mollier para a água. Diagramas mais completos e diagramas T x s para a água podem ser encontrados na bibliografia citada. Para o estudo de sistemas de refrigeração é mais conveniente apresentar as propriedades em diagramas que tenham como ordenada a pressão absoluta e como abcissa a entalpia específica. A figura 2.5-6 é o diagrama para o refrigerante R-12, a Figura 2.5-7 é o diagrama para o refrigerante R-22, a figura 2.5-8 é o diagrama para o refrigerante R-134a e a figura 2.5-9 é o diagrama P x h para a amônia, que pela classificação da ASHRAE (American Society of Heating, Refrigerating, and Air-Conditioning Engineers.) é o refrigerante R-717. 27
- 28. Capítulo - 2 - Termodinâmica Aplicada - pág. - 31 Figura 2.5 - 4 - Diagrama de Mollier (h x s) para a água 28
- 29. Capítulo - 2 - Termodinâmica Aplicada - pág. - 32 Figura 2.5-5 Parte do diagrama de Mollier para a água 29
- 30. Capítulo - 2 - Termodinâmica Aplicada - pág. - 33 Figura 2.5-6 - Diagrama P x h para o refrigerante R-12 30
- 31. Capítulo - 2 - Termodinâmica Aplicada - pág. - 34 Figura 2.5-7 - Diagrama P x h para o refrigerante R-22 31
- 32. Capítulo - 2 - Termodinâmica Aplicada - pág. - 35 Figura 2.5 - 8 - Diagrama P x h para o refrigerante R-134a 32
- 33. Capítulo - 2 - Termodinâmica Aplicada - pág. - 36 Figura 2.5 - 9 Diagrama P x h (sem a parte central) para o refrigerante R-717 (Amônia) 33
- 34. Capítulo - 2 - Termodinâmica Aplicada - pág. - 37 Exemplo 2.5-1 Vapor de água inicialmente a 4,0 MPa e 300 o C (estado 1) está contido em um conjunto êmbolo - cilindro. A água é então resfriada a volume constante até sua temperatura alcançar 200 o C (estado 2). A seguir a água é comprimida isotermicamente até um estado onde a pressão é de 2,5 MPa (estado 3). a) Determine o volume específico nos estados 1, 2 e 3, em m 3 / kg e o título no estado 2 se o estado 2 for de vapor úmido. b) Localize os estados 1, 2 e 3 e esquematize os processos em um diagrama T- v e P- v. Solução: - Hipóteses: - O vapor de água é o nosso sistema termodinâmico - Em cada estado o sistema está em equilíbrio termodinâmico Conhecido: O estado inicial P= 40 bar e T= 300 o C e os processos subseqüentes a-1) da tabela de vapor saturado para a água na pressão de 40 bar a correspondente temperatura de saturação é 250,4 o C. Assim a água a 40 bar e 300 o C está superaquecida. Da tabela de vapor superaquecido temos v1 = 0,05884 m 3 /kg a-2) Para determinarmos o estado 2 temos o volume específico que é igual ao volume específico do estado 1, v2 = 0,05884 m 3 /kg e a temperatura de 200 o C da tabela de vapor saturado, para a temperatura de 200 o C, a respectiva pressão de saturação é 15,54 bar. O volume específico do líquido saturado vale; v2L = 0,0011565 m 3 /kg e do vapor saturado seco, v2v = 0,1274 m 3 /kg. Como o volume específico do estado 2 está entre o volume específico do líquido e do vapor saturado, então inferimos que o estado 2 é de vapor úmido. Nos dois diagramas, o processo de 1→→ 2 é indicado através de uma linha vertical desde o estado 1 até o estado 2 cuja temperatura é de 200 o C e a pressão é de 15,54 bar, na região de vapor úmido. a-3) O estado 3 cuja pressão é de 25 bar a temperatura é a mesma do estado 2, 200 o C. Como a pressão, 25 bar é maior que a pressão de saturação correspondente podemos facilmente inferir do diagrama T x v que o estado é de líquido comprimido. O processo de 2 →→ 3 está indicado nas figuras do item b). a-4) O volume do estado 1 e 2 são iguais, e seu valor lido da tabela de vapor superaquecido, é 0,05884 m 3 /kg. O volume específico do estado 3 deve ser obtido em uma tabela de líquido comprimido, cujo valor é, v3 = 0,0011555 m 3 /kg ou de forma aproximada, de uma tabela de saturação na temperatura de 200 o C, independentemente da pressão de saturação correspondente, que é v3 = 0,0011565 m 3 /kg. a-5) O título no estado 2 é obtido usando as relações matemáticas entre título e volume específico, como já mostrado anteriormente, assim: x v v v v ouL v L 2 2 2 2 2 0 05884 0 0011565 01274 0 0011565 0 457 45 7== −− −− == −− −− == , , , , , , % b) Representação dos estados e dos processos nos planos T x v e P x v 34
- 35. Capítulo - 2 - Termodinâmica Aplicada - pág. - 38 Exemplo 2.5-2 Em um equipamento de refrigeração industrial, cujo fluido de trabalho é a amônia, (R-717) o dispositivo de expansão (válvula de expansão termostática) reduz a pressão do refrigerante de 15,850 kgf/cm2 e líquido saturado (estado1) para a pressão de 1,940 kgf/cm2 e título, X = 0,212 (estado 2). Determinar: a) O volume específico, a temperatura e a entalpia específica nos estados 1 e 2 b) Representar o processo de expansão na válvula nos diagramas h-s e P-h c) A que processo ideal mais se aproxima o processo de expansão na válvula de expansão termostática (isocórico, isotérmico, isentrópico, isentálpico, isobárico) Solução: a-1) da tabela de saturação para a amônia obtemos as propriedades do líquido saturado na pressão de 15,850 kgf/cm 2 (estado 1) T1= 40 0 C, V1= 0,0017257 m 3 /kg, h1=145,53 kcal/kg, S1=1,1539 kcal/kg-K a-2) As propriedades do estado 2 devem ser determinadas utilizando-se a definição de título. Assim, para a pressão de 1,940 kgf/cm 2 as proprie- dades de líquido e vapor saturado são: T = - 20 o C V2 = V2L + X2 (V2V - V2L); V2L = 0,0015037 m 3 /kg, V2V = 0,6237 m 3 /kg V2 = 0,0015037 + 0,212 (0,6237 - 0,0015037) →→ V2 = 0,1334 m 3 /kg h2 = h2L + X2 (h2V - h2L); h2L= 78,17 kcal/kg, h2V = 395,67 kcal/kg h2 = 78,17 + 0,212 (395,67 - 78,17) →→ h2 = 145,48 kcal/kg S2 = S2L + X2 (S2V - S2L); S2L = 0,9173 kcal/kg-k, S2V = 2,1717 kcal/kg-K S2 = 0,9173 + 0,212 (2,1717 - 0,9173) →→ S2 = 1,1832 kcal/kg-K b) Representação do processo e dos estados termodinâmicos 1 e 2 c) O processo ideal mais próximo é o processo ISENTÁLPICO. (em qualquer processo de estrangulamento o processo ideal é o processo a entalpia constate, o fluido neste caso é acelerado, de forma que, o tempo de contato entre o fluido e a superfície envolvente é extremamente pequeno não havendo tempo suficiente para a troca de calor, então, h1 ≅≅ h2). 35
- 36. Capítulo - 2 - Termodinâmica Aplicada - pág. - 39 Exemplo 2.5-3 Uma turbina a vapor pode ser operada em condições de carga parcial estrangulando-se o vapor que entra na turbina através de uma válvula. (o processo de estrangulamento é um processo isentálpico) . As condições do vapor de água na linha de alimentação são P1=10 bar e T1=300 O C. O vapor deixa a turbina com pressão, P3 = 0,1 bar. Como hipótese simplificadora adotemos que a turbina é uma máquina adiabática reversível. (processo de expansão isentrópico). Pede-se indicar os processos em um diagrama h x S e obter os dados de h, s, x, T, para: a) Turbina operando a plena carga b) Turbina operando em carga parcial com pressão saindo da válvula de estrangulamento (V.R.P), P2 = 5,0 bar SOLUÇÃO - Valores lidos do próprio diagrama de MOLLIER , portanto, valores aproximados. 36
- 37. Capítulo - 2 - Termodinâmica Aplicada - pág. - 40 Continuação do Exemplo 2.5-3 - Solução através das tabelas de propriedades. caso a) - Neste caso, turbina operando a plena carga, significa que a válvula controladora na entrada da turbina não opera (é o mesmo que não existir) estado 1, P1 = 10 bar e T1 = 300 o C como já sabemos, da solução anterior, este é um estado de vapor superaquecido, assim da tabela de vapor superaquecido, obtemos; h1 = 3051,2 kJ / kg v1 = 0,2579 m3 /kg S1 = 7,1229 kJ /kg-K Estado 3 Processo isentrópico do estado 1 ao estado 3, então, S3 = S1 = 7,1229 kJ/kg-K (da solução anterior, também sabemos que o estado 3 é de vapor úmido (se não tivéssemos a solução gráfica direta no diagrama de Mollier, teríamos que verificar esta condição !) e pressão de P3 = 0,1 bar . Assim obtemos das tabelas de saturação os valores para vapor saturado e para líquido saturado, e com a equação que relaciona título com as demais propriedades na região de vapor úmido podemos calcular o título pois sabemos o valor da entropia. Assim; hls = 191,83 kJ/kg, hvs = 2584,7 kJ/kg, vls = 0,0010102 m3 /kg, vvs = 14,674 m3 /kg Sls = 0,6493 kJ/kg-K, Svs = 8,1502 kJ/kg-K S3 = Sls + X3(Svs - Sls) → %3,86ou863,0 6494,01502,8 6493,01229,7 SS SS X lsvs ls3 3 == −− −− == −− −− == logo: h3= 191,83 + 0,863 (2584,7 - 191,83) = 2 256,9 kJ/kg v3 = 0,0010102 + 0,863 (14,674 - 0,0010102) = 12, 664 m3 /kg caso b) Aqui, antes de ocorrer a expansão na turbina, ocorre o estrangula- mento na válvula controladora da pressão de 10 bar para 5 bar. Como o processo é isentálpico, a entalpia do estado 2 é igual àentalpia do estado 1, e como sabemos, o estado 2 é de vapor superaquecido. da tabela de vapor superaquecido para P2 = 5,0 bar e h2 = 3 051,2 kJ/kg, interpolando na tabela, obtemos: T2 = 293,6 o C , v2 = 0,5164 m3 /kg, S2 = 7,4344 kJ/kg-K O estado 3, como sabemos da solução anterior , é de vapor úmido, o procedimento para se obter os dados é o mesmo do item a) resultando: para P3 = 0,1 bar e S3 = S2 X3 = 90,46 %, h3 = 2356,35 kJ/kg, v3 = 13,2738 m3 /kg Obs. Assim, concluímos que a solução gráfica é bem mais rápida e significativa 37
- 38. Capítulo - 2 - Termodinâmica Aplicada - pág. - 41 Exercícios 2-6) Em que fase se encontra a água, contida em um recipiente de paredes rígidas, em que a temperatura é de 100 o C e a pressão é de a) 10 MPa, b) 20 kPa. Obs.: Use a tabela de propriedades saturadas para inferir a resposta. 2-7) Em um gerador de vapor industrial a água entra com pressão de 10 bar e temperatura de 150 o C (estado 1). A água sai desse gerador após receber calor em um processo isobárico àtemperatura de 250 o C, (estado 2). Pede-se: a) em que fase se encontram os estados 1 e 2 ? b) Represente esquematicamente o processo de aquecimento da água nos seguintes diagramas de propriedades: b-1) Coordenadas h x s (Entalpia versus Entropia) b-2) Coordenadas T x s (Temperatura versus Entropia) b-3) Coordenadas P x h (Pressão versus Entalpia 2-8) Um tanque, cujo volume é de 0,053 m3 , contém freon 12, (R-12) a 40 o C. O volume inicial de líquido no tanque é igual ao volume de vapor. Uma quantidade adicional de Freon - 12 é forçada para dentro do tanque até que a massa total dentro do tanque atinja 45 kg. Pede-se; a) Qual o volume final de líquido no tanque admitindo-se que a temperatura seja de 40 o C? b) Que quantidade de massa foi adicionada ao tanque? 2-9) Em uma geladeira domestica, o condensador, que é um trocador de calor de convecção natural, (fica atrás da geladeira) é projetado para que o refrigerante saia deste no estado de líquido saturado. Em particular, em uma geladeira domestica cujo refrigerante é o R-134a, o condensador apresenta problemas e o refrigerante sai com pressão de 1682,76 kPa e título de 0,15. Determinar; a) A temperatura e o volume específico do refrigerante neste estado. b) Esquematizar o processo de resfriamento do refrigerante se este foi resfriado isobaricamente da temperatura de 90 o C até o estado final, em um diagrama P-h (Pressão - Entalpia) 2-10) O compressor de um sistema frigorífico deve sempre aspirar vapor superaquecido. Determinar as propriedades termodinâmicas do R-22 quando a pressão de sucção for de 2,0 kgf/cm2 e estiver superaquecido de 15 o C 2-11) Determine as propriedades termodinâmicas do R-12 à pressão de 10 kgf/cm2 e temperatura de 34 o C. Em que região se encontra a substância 38
- 39. Capítulo 4 - Primeira Lei PRIMEIRA LEI DA TERMODINÂMICA Sistemas fechados A estrutura da termodinâmica assenta em duas leis fundamentais. Estas leis não se podem demonstrar; são axiomas. A sua validade é estabelecida com base no facto de a experiência não a contradizer, nem contradizer as consequências que dela se podem deduzir. A 1ª lei da termodinâmica é relativa ao princípio de conservação de energia aplicado a sistemas fechados onde operam mudanças de estado devido à transferência de trabalho e de calor através da fronteira. Permite calcular os fluxos de calor e de trabalho quando são especificadas diferentes variações de propriedades. Exemplos:Trabalho necessário para comprimir uma dado fluido num compressor. Ciclo necessário para produzir vapor a uma dada pressão e temperatura numa caldeira A 2ª lei da termodinâmica indica que quantidade de calor, geralmente produzida por uma turbina, pode ser convertida em trabalho (motor térmico, máquina térmica) ou indica que quantidade de trabalho deverá ser fornecida para se extrair uma dada quantidade de calor (máquina frigorífica) Termodinâmica Eng. Ambiente (Nocturno) 1º Ano 4.1 39
- 40. Capítulo 4 - Primeira Lei Permite concluir que é impossível converter todo o calor fornecido a uma máquina térmica em trabalho; algum calor terá de ser rejeitado. Propriedades pressão (p) volume específico (v) temperatura (t) energia interna (u) entalpia (h) entropia (s) Duas propriedades são seleccionadas para definir o estado do sistema em equilíbrio. As restantes quatro são consequência imediata e estão fixas. Nota: cuidado com a escolha das propriedades independentes. Exemplo 1: a massa e volume específicos não são propriedades independentes; uma é o inverso da outra. Exemplo 2: a pressão e a temperatura não são variáveis independentes. Deve utilizar-se outro par de propriedades para definir o estado, por exemplo, p e v. Termodinâmica 4.2 Eng. Ambiente (Nocturno) 1º Ano 40
- 41. Capítulo 4 - Primeira Lei Se se conhecer duas propriedades de um estado as restantes podem ser determinadas através de expressões analíticas ou de resultados experimentais. Conhecendo, por exemplo, p e v, a terceira propriedade x, tal que x=f(p,v). Nalguns casos f é simples e conhece-se analiticamente (pv=RT). Noutros casos conhecem-se tabelas experimentais. 1ª Lei da Termodinâmica ou Princípio de Conservação de Energia. A energia não pode ser criada ou destruída. A energia pode ser: Armazenada Transformada de uma forma para outra Transferida de um sistema par outro (ou para a vizinhança) A energia pode atravessar a fronteira sob duas formas – Calor ou Trabalho Termodinâmica 4.3 Eng. Ambiente (Nocturno) 1º Ano 41
- 42. Capítulo 4 - Primeira Lei Calor e trabalho Só o trabalho e o calor podem mudar o estado. O trabalho atravessa a fronteira do sistema; transfere-se. “Trabalho é algo que surge nas fronteiras quando o sistema muda o seu estado devido ao movimento de parte da fronteira por acção de uma força.” “Não se pode afirmar que o sistema tem um dado trabalho”. Formas mecânicas de trabalho Força F constante. Força F qualquer Realiza-se trabalho pelo sistema na vizinhança se o único efeito sob algo externo ao sistema poder ser considerado como elevação de um peso. W > 0 → trabalho realizado pelo sistema W < 0 → trabalho realizado sobre sistema Cálculo de W ⇒ saber como F varia ao longo de s O valor do integral depende do processo. O trabalho W não é uma propriedade do sistema Termodinâmica 4.4 ∫ →→ ⋅= 2 1 dsFW →→ ⋅= sFW Eng. Ambiente (Nocturno) 1º Ano 42
- 43. Capítulo 4 - Primeira Lei Potência – taxa de transferência de energia na forma de trabalho. Unidades: J/s =W, kW, MW Trabalho de expansão ou de compressão Força: F = pA, onde p é a pressão na interface Trabalho realizado pelo sistema δW= Fdx =pAdx = pdV δW = p dV dV > 0 ⇒ δW > 0 (Expansão) dV < 0 ⇒ δW < 0 (Compressão) onde δW não é um diferencial exacto Termodinâmica 4.5 ∫ ∫ ⋅== t2 t1 2 1 12 ,dtVFdtWW rr & W& ∫ ∫== 2 1 2 1 12 ,pdVδWW Eng. Ambiente (Nocturno) 1º Ano 43
- 44. Capítulo 4 - Primeira Lei Trabalho de expansão ou de compressão - processo quasi- estático Processo de quasi-equilíbrio – sucessão de estados de equilíbrio. O valor das propriedades intensivas é uniforme onde p é a pressão uniforme Expansão: ∫>0 ⇒ W>0 Compressão: ∫<0 ⇒ W<0 A relação entre p-v pode ser dada analiticamente Processo politrópico → pvn = constante n = 0 → p = constante processo → processo isobárico n = ∞ → v = constante processo → processo isócoro Termodinâmica 4.6 ∫= 2 1 12 pdV,W Eng. Ambiente (Nocturno) 1º Ano 44
- 45. Capítulo 4 - Primeira Lei Trabalho de aceleração – energia cinética 2ª Lei de Newton: F=ma O ∫Fsds - trabalho da força - é igual à variação de energia cinética. ∆Ec= WFS. A energia cinética é uma propriedade. Trabalho gravitacional – energia potencial Conhecido z1 e z2 pode calcular a energia potencial Ep1 e Ep2 A energia potencial é uma propriedade extensiva. O trabalho de todas as forças (excepto o peso) é igual à variação de energia potencial + energia cinética Termodinâmica 4.7 →→→ += sn FFF ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ −==⇒= ∫∫ 2 V 2 V mmVdVdsFmVdVdsF 2 1 2 2 2 1 2 1 ss ds dV mV dt ds ds dV m dt dV mFs === ( )2 1 2 2 2 1 c VVm 2 1 EFdz −=∆=∫ gmRF rrr −= pc z z 2 1 z z c 2 1 ∆E∆ERdz∆EmgdzRdzFdz 2 1 2 1 +=⇒=−= ∫∫ ∫∫ Eng. Ambiente (Nocturno) 1º Ano 45
- 46. Capítulo 4 - Primeira Lei Fr aumenta z ou acelera o corpo ⇒ o W realizado é transferido como energia para o corpo A energia total mantêm-se constante. Referencial de Energia cinética e Potencial: Ec = 0 se v =0 em relação à terra. Ep = 0 se o corpo se encontra num determinado nível de referência. Somente interessam diferenças de energia entre dois estados Trabalho de extensão de uma barra sólida Termodinâmica 4.8 0∆EE0W0R pcR =+∆⇔=⇒= pcR ∆E∆EW += r B FFrB =⇔= Eng. Ambiente (Nocturno) 1º Ano 46
- 47. Capítulo 4 - Primeira Lei Trabalho e potência num veio velocidade angular ω Espaço percorrido em n revoluções – Potência transmitida Trabalho de uma força elástica Onde x1 e x2 são a posição inicial e final da mola Termodinâmica 4.9 ( )nr2s π= r B FFrB =⇔= ( ) πnB2rn2 r B FsW === π ωB n B2π t W W 2π ω n ===⇒= & && n n ( )2 1 2 2 xxk 2 1 kxdxWkxF 2 1 −−=−=⇒= ∫ x x Eng. Ambiente (Nocturno) 1º Ano 47
- 48. Capítulo 4 - Primeira Lei Transferência de calor Calor - Modo de transferência de energia resultante da diferença de temperatura entre dois sistemas (ou um sistema e a vizinhança). O calor, tal como o trabalho, é uma quantidade transiente que aparece na fronteira do sistema. Não existe calor no sistema antes ou depois de um estado. O calor atravessa a fronteira ⇒ a energia é transferida sob a forma de calor do sistema para a vizinhança ou vice-versa. Sentido da transferência – do corpo de maior temperatura para o de menor temperatura – devido a um gradiente de temperaturas. Convenção de sinais: Q > 0 calor transferido para o sistema Q < 0 calor transferido do sistema para a vizinhança Processo Adiabático: quando não ocorre transferência de energia sob a forma de calor entre o sistema e a vizinhança. Sistema isolado termicamente do exterior. Sistema e vizinhança à mesma temperatura. Termodinâmica 4.10 Sistema adiabático Q=0 Eng. Ambiente (Nocturno) 1º Ano 48
- 49. Capítulo 4 - Primeira Lei Transferência de energia sob a forma de calor entre dois estados Q não é uma propriedade do sistema. Q depende do processo Potência calorífica, = constante ⇒ Fluxo de calor A é a área da fronteira Modos de transferência de calor Condução Convecção Radiação térmica Termodinâmica 4.11 21 2 1 Q-QQnuncaeδQQ == ∫ . Q . Q WQdeUnidadedtQQ 2 1 t t →→= ∫ && ∫ == 2 1 t t ∆tQdtQQ && 2 A mWqdeUnidadedAqQ →→= ∫ &&& . q 49
- 50. Capítulo 4 - Primeira Lei Condução Pode ocorrer em gases, líquidos ou sólidos Taxa de transferência de energia ou potência calorífica k – condutibilidade térmica W/m ºC Bons condutores: cobre, prata, alumínio Maus condutores ou isolantes: cortiça, lã, poliestireno, etc. ksólido >k líquido >k gases em geral Radiação Energia emitida por ondas electromagnéticas ou fotões. Não necessita de matéria para se propagar. Todas as superfícies sólidas, gases ou líquidos emitem, absorvem ou transmitem radiação térmica Taxa de transferência de energia ou potência calorífica ε – emissividade 0<ε< 1; A - área da superfície(m2) Tb – temperatura da superfície (K); σ – constante de Boltzmann = 5,669x10-8 W/m2K4 Termodinâmica 4.12 Q& →−= . x x dx dT kAQ& Lei de Fourier →= . 4 be TεAσQ& Lei de Stefan- Boltzmann Eng. Ambiente (Nocturno) 1º Ano 50
- 51. Capítulo 4 - Primeira Lei Convecção Efeito combinado de condução de calor e movimentação de um fluido. Taxa de transferência de energia ou potência calorífica h – coeficiente de convecção – W/m2 ºC h não é uma propriedade e depende de: - do fluido - do tipo de escoamento - do tipo de superfície Convecção Forçada – movimento do fluido provocado por forças exteriores -forças gravíticas, de pressão, etc. Natural – movimento do fluido provocado por forças de impulsão devido a diferenças de temperatura e consequente diferenças de densidade Termodinâmica 4.13 ( ) →= fb T-TAhQ& Lei de Newton Natural Forçada Eng. Ambiente (Nocturno) 1º Ano 51
- 52. Capítulo 4 - Primeira Lei Unidade clássica de Calor “quantidade de calor que é necessário fornecer à unidade de massa da água para aumentar a sua temperatura de 1ºC, à pressão atmosférica padrão” (definição de caloria) Conclui-se, posteriormente, que a quantidade de calor depende do ponto de temperatura escolhido. kcal 14,4ºC - 15,5ºC Btu 1 lbm de 1ºF Celsius Heat Unit 1 lbm de 1ºC Resumo Nem o calor nem o trabalho são propriedades Ambos são quantidades transientes que atravessam a fronteira quando há mudança de estado. O calor e o trabalho podem ser utilizados para descrever um processo Termodinâmica 4.14 Eng. Ambiente (Nocturno) 1º Ano 52
- 53. Capítulo 4 - Primeira Lei Energia do Sistema Primeira Lei da Termodinâmica: Num sistema fechado o trabalho realizado, entre dois estados num processo adiabático depende somente do estado inicial e final e é independente dp processo adiabático escolhido O trabalho é igual em todos os processos adiabáticos. Existe pelo menos uma propriedade E – energia total. Só tem significado falar em variação de energia E – energia total → cinética + potencial + outras formas energia. Outras formas energia → energia interna U A energia interna U é uma propriedade extensiva. A variação global de energia é dada por Termodinâmica 4.15 ( ) ( ) ( ) UEEEouUUEEEEEE pc12p1p2c1c212 ∆+∆+∆=∆−+−+−=− ad12 WEE −=− Eng. Ambiente (Nocturno) 1º Ano 53
- 54. Capítulo 4 - Primeira Lei Sistemas Fechados Os sistemas fechados podem interagir com o exterior através de trabalho ou calor. A experiência mostra que o trabalho realizado nos processos não adiabáticos é diferente dos processos adiabáticos. A variação de energia no processo adiabático é igual à dos não adiabáticos onde Q é a energia transferida sob a forma de calor. Termodinâmica 4.16 B12A12ad12 adBadA WEEWEEWEE WWWW −≠−∧−≠−⇒−=− ≠≠ ( ) WQEEWEEQ 1212 −=−⇔+−= Eng. Ambiente (Nocturno) 1º Ano 54
- 55. Capítulo 4 - Primeira Lei Balanço de Energia para Sistemas Fechados O aumento ou redução de energia é igual ao saldo através da fronteira. A transferência de energia através da fronteira origina um aumento de pelo menos uma das formas de energia: cinética, potencial ou interno Diferentes Formas da Equação de Balanço de Energia. Diferencial: Equação de Balanço sob a forma de Potência Termodinâmica 4.17 ⎥ ⎥ ⎥ ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎢ ⎢ ⎢ ⎣ ⎡ − ⎥ ⎥ ⎥ ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎢ ⎢ ⎢ ⎣ ⎡ = ⎥ ⎥ ⎥ ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎢ ⎢ ⎢ ⎣ ⎡ tempode intervaloodeterminadumdurante trabalhodeformaasobfronteirada atravéssistemadoexterioropara atransferidenergiadeQuantidade tempode intervaloodeterminadumdurante calordeformaasobfronteirada atravéssistemadointerioropara atransferidenergiadeQuantidade tempode intervaloodeterminadum durantesistemadointerior nocontidaenergiade quantidadedaVariação WQUEE pc −=∆+∆+∆ δW-δQdE = ⎥ ⎥ ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎢ ⎢ ⎣ ⎡ − ⎥ ⎥ ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎢ ⎢ ⎣ ⎡ = ⎥ ⎥ ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎢ ⎢ ⎣ ⎡ ttt instantenotrabalhodeformaa sobfronteiradaatravéssistema doexterioroparaenergiade ciatransferêndelíquidaTaxa instantecalornodeformaa sobfronteiradaatravéssistema dointerioroparaenergiade ciatransferêndelíquidaTaxa instantenosistema dointeriornocontida energiadequantidade davariaçãodeTaxa W-Q dt dU dt dE dt dE dt dE pc &&=++= Eng. Ambiente (Nocturno) 1º Ano 55
- 56. Capítulo 4 - Primeira Lei Simplificações para alguns processos (Revisão) Processos isócoros (a volume constante) Nestes processos tem-se W=0. Substituindo na equação de energia resulta (a menos de um trabalho negativo dissipativo). Processos isobáricos (a pressão constante) Sendo o processo reversível tem-se . Como p é constante, por integração resulta Quando p é constante, tem-se . Termodinâmica 4.18 dupdv m dQ =− 12 uu m Q −= dupdv m dQ =− ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − = oTT eRR 11 0 β ⇔+=⇔ ⇔=− dupdv m dQ dupdv m dQ dh m dQ =⇔ Eng. Ambiente (Nocturno) 1º Ano 56
- 57. Capítulo 4 - Primeira Lei sendo a entalpia especifica do estado Integrando obtêm-se Processos politrópicos Em processos politrópicos reais verifica-se a seguinte relação sendo n o índice de expansão (ou compressão) e p e v, valores médios do sistema. Verifica-se que com: n=0, reduz-se a p = const. (processo isobárico); n=∞, reduz-se a v = const. (processo isócoro); Termodinâmica 4.19 pvuh += 12 hh m Q −= .constpvn = Eng. Ambiente (Nocturno) 1º Ano 57
- 58. Capítulo 4 - Primeira Lei Para processos politrópicos reversíveis tem-se: Caso n=1 Caso n≠1 Termodinâmica 4.20 ( ) ( ) 1)ncomreversívelopolitrópic processoparaenergiade(eq.ln lnlnln 1 12 1 2 11 1 2 11121111 11 11 2 1 2 1 = −=⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ −∗ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ =⇔−===∗ =⇔=∗ ∫∫ uu v v vp m Q v v vp m W vvvpdv v vppdv m W v vp ppvvp v v v v ( ) ( ) 1)ncomreversívelopolitrópic processoparaenergiade(eq. 1 1 11 1 12 1122 1122 1 111 1 222 1 1 1 2 1111 2211 2 1 2 1 ≠ −= − − −∗ − − =⇔ ⇔ − − = − − ===∗ ⇔=∗ −−−− ∫∫ uu n vpvp m Q n vpvp m W n vvpvvp n vv vpdv v vppdv m W pvvpvp nnnnnn n v v n n v v nnn Eng. Ambiente (Nocturno) 1º Ano 58
- 59. Capítulo 4 - Primeira Lei Processos adiabáticos Num processo adiabático reversível não se verificam trocas de calor através da fronteira do sistema, i.e., este está termicamente isolado da vizinhança. Assim, como Q=0, a equação de energia resulta Num processo adiabático reversível tem-se dQ=0 (neste processo s=const. e ds=0). Assim, conhecido o estado inicial de um dado processo, basta conhecer o valor de uma única propriedade do estado final para além da entropia (que é constante), para determinar o trabalho realizado ou a variação de energia interna do sistema. Processos isótermicos (a temperatura constante) Num processo isotérmico, o calor e o trabalho são transferidos de tal forma que a temperatura do sistema permanece constante. Como não há gradientes de temperatura, está implícita a reversibilidade do processo. Nota: por vezes designam-se por isotérmicos processos irreversíveis em que apenas a temperatura média é constante. Termodinâmica 4.21 ( )21 uu m W −= Eng. Ambiente (Nocturno) 1º Ano 59
- 60. Capítulo 4 - Primeira Lei Como em qualquer processo reversível, ou Também se verificam as relações e T=const , resultando Pelo que o trabalho pode ser determinado a partir de Nota Final Em resumo tem-se para processos politrónicos Processo isobárico (pressão constante): n=0; Processo isotérmico (temperatura constante): n=1; Processo isentrópico (entropia constante): n=γ; Processo isócoro (volume constante): n=∞. Outros processos podem ainda ser aproximados por um valor apropriado do expoente n da politrópica. Termodinâmica 4.22 dupdv m dQ =− ( )12 2 1 uupdv m Q v v −=− ∫ ( )12 ssT m Q −= Tds m dQ = ( )12 2 1 uupdv m Q v v −=− ∫ .constpvn = Eng. Ambiente (Nocturno) 1º Ano 60
- 61. Capítulo 4 - Primeira Lei Sistemas abertos (regime estacionário) Massa no instante t Massa no instante t+∆t (mi=0) Por conservação da massa ou Termodinâmica 4.23 ( )tmmm vci += ( )ttmmm vce ∆++= ( ) ( ) eivcvc mmtmttm −=−∆+ ( ) ( )ttmmtmm vcevci ∆++=+ Eng. Ambiente (Nocturno) 1º Ano 61
- 62. Capítulo 4 - Primeira Lei Em termos de taxa de tempo, vem ou a taxa instantânea Vem Para n entradas e saídas ou por palavras Termodinâmica 4.24 ( ) ( ) t m t m t tmttm eivcvc ∆ − ∆ = ∆ −∆+ ( ) ( ) dt md t tmttm vcvcvc t =⎥⎦ ⎤ ⎢⎣ ⎡ ∆ −∆+ →∆ 0 lim i i t m t m &=⎥⎦ ⎤ ⎢⎣ ⎡ ∆→∆ 0 lim e e t m t m &=⎥⎦ ⎤ ⎢⎣ ⎡ ∆→∆ 0 lim ei vc mm dt md && −= ∑∑ −= e e i i vc mm dt md && Taxa de variação da massa contida no interior do volume de controlo i Caudal mássico total em todas as entradas no instante i Caudal mássico total em todas as saídas no instante i -= Eng. Ambiente (Nocturno) 1º Ano 62
- 63. Capítulo 4 - Primeira Lei Diferentes formas da equação da conservação da massa em termos das propriedades locais Escoamento unidimensional O escoamento é normal à fronteira nas secções de entrada e de saída Todas as propriedades - incluindo velocidade e massa específica – são uniformes em cada secção de entrada ou saída Termodinâmica 4.25 ( ) ( )eA neiA niVvc dAVmdAVmdVm ∫∫∫ === ρρρ && V∆tVn∆t dA ( ) ( )∑ ∫∑ ∫∫ = ei - A nA nV dAVdAVdV dt d ρρρ v AV VAdAV VV dAVm An n A n === ⎪⎭ ⎪ ⎬ ⎫ = = ∫ ∫ ρρ ρ m& & - ∑∑∑∑ =−= e e ee i i ii e e i i vc v VA v VA mm dt md && Eng. Ambiente (Nocturno) 1º Ano 63
- 64. Capítulo 4 - Primeira Lei Escoamento unidimensional estacionário. As propriedades num determinado ponto no interior do volume de controlo não variam com o tempo Para que o escoamento de um fluido possa ser estacionário o caudal mássico deve ser constante e igual à entrada e saída, e as propriedades do fluido em qualquer ponto do sistema não devem variar no tempo, ou seja, todo o “elemento do fluido” (δm) numa dada posição possui sempre o mesmo estado mecânico e termodinâmico. Quando o escoamento nas secções de entrada e saída é unidimensional tem-se sendo A a área da secção e V’ a velocidade do escoamento. Considere a figura Termodinâmica 4.26 0=−= ∑∑ e e i i vc mm dt md && ∑∑ = e e i i mm && A vV m ' = Eng. Ambiente (Nocturno) 1º Ano 64
- 65. Capítulo 4 - Primeira Lei No intante t Entre os instantes t e t+∆t, mi entra no volume de controlo me sai do volume de controlo Durante este intervalo de tempo podem ocorrer trocas de Q e W Substituindo valores virá: Equação de balanço de energia para o volume de controlo em termos de taxa de tempo, vem Termodinâmica 4.27 ( ) ( ) ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++∆+=∆+ e e eevc gz V umttEttE 2 2 ( ) ( ) ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++= i i iivc gz V umtEtE 2 2 ( ) ( ) WQtEttE −=−∆+ ( ) ( ) ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ ++−⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ +++−=−∆+ e 2 e eei 2 i iivcvc gz 2 V umgz 2 V umWQtEttE ( ) ( ) t gz V um t gz V um t W t Q t tEttE e e eei i ii vcvc ∆ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++ − ∆ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++ + ∆ − ∆ = ∆ −∆+ 22 22 Eng. Ambiente (Nocturno) 1º Ano ( ) ( ) WQgz V umtEgz V umttE i i iivce e eevc −=⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ ++−−⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ +++∆+ 22 22 65
- 66. Capítulo 4 - Primeira Lei Ou para valore instantâneos O trabalho na unidade de tempo pode ser dividido em 2 parcelas trabalho associado à pressão do fluido devido à entrada e saída de massa. outras contribuições - - tais como veios rotativos, deslocamentos da fronteira, tensão superficial, etc Trabalho associado à pressão do fluido: Termodinâmica 4.28 ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++−⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++−= e e eei i ii vc gz V umgz V umWQ dt Ed 22 22 &&&& W& vcW& Taxa de transferência de energia por trabalho do volume de controlo na saída. ( ) eee VAp= ( ) ( ) iiiieeeeiiieeevc vmVAvmVAVApVApWW &&&& ==−+= ; ( ) ( )iiieeevc vpmvpmWW &&&& −+= Eng. Ambiente (Nocturno) 1º Ano 66
- 67. Capítulo 4 - Primeira Lei Formas da equação de balanço Fazendo h=u+pv: Para n entradas e saídas: Em conclusão depende = sistemas fechados transferência de energia associada à transferência de massa A equaA equaçção de energia pode ser escrita em termos deão de energia pode ser escrita em termos de propriedades locaispropriedades locais A equaA equaçção de balanão de balançço vemo vem Termodinâmica 4.29 ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++−⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++++−= e e eeeei i iiiivc vc gz V vpumgz V vpumWQ dt Ed 22 22 &&&& ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++−⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++−= e e eei i iivc vc gz V hmgz V hmWQ dt Ed 22 22 &&&& ∑∑ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++−⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++−= e e e ee i i i iivc vc gz V hmgz V hmWQ dt Ed 22 22 &&&& dtEd vc vc vc W Q & & ∫∫ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++== VVvc dVgz V udVeE 2 2 ρρ ∑∫∑∫∫ ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++−⎥ ⎦ ⎤ ⎢ ⎣ ⎡ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++−= e A e n i A i nvcvcV dAVgz V hdAVgz V hWQdVe dt d ρρρ 22 22 && Eng. Ambiente (Nocturno) 1º Ano 67
- 68. Capítulo 4 - Primeira Lei Resumindo: Análise do volume de controlo em regime estacionário Equação de balanço de energia Para uma só entrada e uma só saída Equação de balanço de energia Ou energia por unidade de massa (kJ/kg) Termodinâmica 4.30 ∑∑ = e e i i mm && 0= dt Ed vc ∑∑ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ++−⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++−== e e e ee i i i iivc vc gz V hmgz V hmWQ dt Ed 22 0 22 &&&& ∑∑ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++=⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ +++ e e e eevc i i i ii gz V hmWgz V hmQ 22 22 &&&& mmm &&& == 21 ( ) ( ) ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎣ ⎡ −+⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ −+−+−= 21 2 2 2 1 21 22 0 zzg VV hhmWQ vcvc &&& ( ) ( ) ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎣ ⎡ −+⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ −+−+−= 21 2 2 2 1 21 22 0 zzg VV hh m W m Q vcvc & & & & Eng. Ambiente (Nocturno) 1º Ano 68
- 69. Capítulo 4 - Primeira Lei Note-se que esta equação é válida se, se assumir que: Caudais de massa, à entrada e saída são constantes e iguais; Propriedades constantes no tempo (ou periódicas); Propriedades constantes nas secções de entrada e saída (ou consideram-se os seus valores médios); Trocas de calor e trabalho que existam, dão-se a taxas constantes (ou admite-se a média em vários ciclos). Termodinâmica 4.31 Eng. Ambiente (Nocturno) 1º Ano 69
- 70. Capítulo 4 - Primeira Lei Tubeira ou Difusor: Equação de balanço de Energia: Turbina: Equação de balanço de Energia: Turbina Adiabática: Desprezando a variação de energia cinética. Termodinâmica 4.32 ( ) ( ) ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎣ ⎡ −+⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ −+−+−= 21 2 2 2 1 21 22 0 zzg VV hh m W m Q vcvc & & & & 22 2 2 2 1 12 VV hh −=− ( ) ( )⎥ ⎦ ⎤ ⎢ ⎣ ⎡ −+⎟ ⎠ ⎞ ⎜ ⎝ ⎛ −+−+−= 21 2 2 2 1 21 22 0 zzg VV hh m W m Q vcvc & & & & ( ) ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ −+−= 22 2 1 2 2 12 VV hh m Wvc & & ( )12 hh m Wvc −= & & Eng. Ambiente (Nocturno) 1º Ano 70
- 71. Capítulo 4 - Primeira Lei Compressor: Equação de balanço de Energia: Compressor Adiabática: Desprezando a variação de energia cinética. Termodinâmica 4.33 ( ) ( )⎥ ⎦ ⎤ ⎢ ⎣ ⎡ −+⎟ ⎠ ⎞ ⎜ ⎝ ⎛ −+−+−= 21 2 2 2 1 21 22 0 zzg VV hh m W m Q vcvc & & & & ( ) ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ −+−= 22 2 2 2 1 21 VV hh m Wvc & & ( )21 hh m Wvc −= & & Eng. Ambiente (Nocturno) 1º Ano 71
- 72. Capítulo 4 - Primeira Lei Permutadores de Calor: Equação de balanço de Energia: Termodinâmica 4.34 ( ) ( )⎥ ⎦ ⎤ ⎢ ⎣ ⎡ −+⎟ ⎠ ⎞ ⎜ ⎝ ⎛ −+−+−= 21 2 2 2 1 21 22 0 zzg VV hh m W m Q vcvc & & & & Eng. Ambiente (Nocturno) 1º Ano 72
- 73. Capítulo 4 - Primeira Lei Válvulas de laminagen: Equação de balanço de Energia: Termodinâmica 4.35 ( ) ( )⎥ ⎦ ⎤ ⎢ ⎣ ⎡ −+⎟ ⎠ ⎞ ⎜ ⎝ ⎛ −+−+−= 21 2 2 2 1 21 22 0 zzg VV hh m W m Q vcvc & & & & mmm &&& == 21 22 2 2 2 2 1 1 V h V h +=+ Eng. Ambiente (Nocturno) 1º Ano 73
- 74. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 19 4.6 - Conservação de Massa Na seção anterior consideramos o primeiro princípio da termodinâmica para um sistema que sofre uma mudança de estado. Um sistema já foi definido como tendo uma quantidade fixa de massa. Surge agora uma pergunta: variará a massa do sistema quando houver variação de energia do sistema? Se isto acontecer, então a nossa definição de sistema como tendo uma quantidade fixa de massa não mais será válida, quando variar a energia do sistema. Da teoria da relatividade, sabemos que a massa e a energia estão relacionadas pela equação bastante conhecida E mC== 2 (4.6-1) onde C é a velocidade da luz, m a massa e E é a energia. Concluímos a partir dessa equação que a massa de um sistema varia quando sua energia varia. Calculemos a grandeza dessa variação de massa para um problema típico e determinemos se essa variação é ou não significativa. Consideremos um recipiente rígido que contém 1,0 kg de uma mistura estequiométrica de um hidrocarboneto combustível (por exemplo, gasolina, C8H18) e ar, que constitui o nosso sistema. Do nosso conhecimento do processo de combustão, sabemos que após a realização desse processo, será necessário transferir cerca de 2900 kJ de calor do sistema para o meio para que seja restabelecida a temperatura inicial do sistema. Do primeiro princípio 1 2 2 1 1 2Q U U W== −− ++ como, 1W2 = 0, e 1Q2 = - 2 900 kJ , concluímos que a energia interna do sistema decresceu de 2 900 kJ durante o processo de troca de calor. Calculemos, agora, a diminuição de massa durante o processo, utilizando a Eq. 4.6-1. A velocidade da luz é 2,9979x10 8 m/s. Portanto 2 900 000 (J) = m (kg) . (2,9979x10 8 (m/s)) 2 → m = 3,23 x10 -11 kg Portanto, quando a energia do sistema varia de 2 900 kJ a redução de massa do sistema será de 2,23 x 10 -11 kg. Uma variação de massa dessa ordem de grandeza não pode ser detectada pela balança analítica de maior precisão. Certamente, uma variação relativa de massa dessa ordem de grandeza está além da precisão requerida essencialmente para todos os cálculos da engenharia. Portanto se usarmos as leis de conservação de massa e energia como leis independentes não introduziremos erros significativos na grande maioria dos problemas termodinâmicos, e nossa definição de sistema, tendo uma massa fixa, pode ser usado mesmo que haja variação de energia do sistema. 74
- 75. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 20 4.7 Conservação de Massa e o Volume de Controle Volume de controle é um espaço que nos interessa para um estudo ou análise particular, igualmente como foi definido anteriormente para o sistema termodinâmico. O espaço é demarcado pela superfície de controle, sendo esta uma superfície fechada. Como para o sistema, o volume de controle pode ter uma superfície de controle real ou imaginária, fixa ou móvel rígida ou flexível. Entretanto a superfície deve ser determinada em relação a algum sistema de coordenadas. A massa bem como o calor e o trabalho podem atravessar a superfície de controle, e a massa contida no interior do volume de controle, bem como suas propriedades, podem variar no tempo. A Fig. 4.7-1 mostra o esquema de um volume de controle com transferência de calor, trabalho de eixo, acumulação de massa dentro do volume de controle e movimento de superfície. O princípio de conservação de massa para o volume de controle é introduzido usando-se a Fig. 4.7-2, a qual mostra um sistema (linha contínua) constituído de uma quantidade fixa de matéria , m, que ocupa diferentes regiões no tempo " t " e no tempo " t+dt ". No seu interior temos o volume de controle, (delimitado pelas linhas tracejadas). No tempo " t " a quantidade de massa dentro do sistema, m, sob consideração é a soma m m t mVC e== ++( ) δδ (4.7-1) onde mVC(t) é a massa contida dentro do volume de controle e δδme é a massa dentro da pequena região denominada " e " adjacente ao volume de controle como mostrado na Fig. 4.7-2a . Analisemos, agora, o que ocorre com a quantidade fixa de matéria " m " no decorrer do intervalo de tempo dt Figura 4.7-2 - Ilustração usada para desenvolver o princípio da conservação de massa para o volume de controle a) tempo " t " b) tempo " t+dt " Figura 4.7-1 diagrama esquemático de um volume de controle 75
- 76. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 21 No intervalo de tempo dt, toda massa na região " e " atravessa a superfície do volume de controle, enquanto um pouco de massa , chamada de δδms, inicialmente contida dentro do volume de controle, sai para encher a região denominada " s " adjacente ao volume de controle como mostra a Fig. 4.7-2b. No instante de tempo t+dt a quantidade de matéria sob consideração no sistema pode ser expressa pela equação: m m t dt mVC S== ++ ++( ) δδ (4.7-2) Observe que as quantidades de massa nas regiões " e " e " s " não são necessariamente iguais e que, a quantidade de matéria dentro do volume de controle pode ter variado. Embora o sistema sob consideração ocupe diferentes regiões no espaço em tempos diferentes, ele contém a mesma quantidade de massa. Assim, m t m m t dt mVC e VC s( ) ( )++ == ++ ++δδ δδ ou rearranjando, m t dt m t m mVC VC e s( ) ( )++ −− == −−δδ δδ (4.7-3) A Eq. 4.7-3 é uma " contabilidade " do balanço de massa, a qual afirma que a variação de massa dentro do volume de controle durante o intervalo de tempo dt é igual à quantidade de massa que entra menos a quantidade de massa que sai do volume de controle. A Eq. 4.7-3 pode ser expressa na base de taxa. Primeiro dividindo-a por dt para obter: m t dt m t dt m dt m dt VC VC e s( ) ( )++ −− == −− δδ δδ (4.7-4) O lado esquerdo desta equação é a taxa média no tempo da variação de massa dentro do volume de controle durante o intervalo de tempo dt. Os termos do lado direito, envolvendo a massa que cruza a superfície de controle, são as taxas médias no tempo do fluxo mássico durante o mesmo intervalo de tempo dt. A equação para a taxa instantânea de massa é obtida tomando-se o limite de dt tendendo para zero na Eq. 4.7-4. No limite o volume de controle e o sistema coincidem. Assim, o limite do termo do lado esquerdo da Eq. 4.7-4 é: lim ( ) ( ) dt VC VC VCm t dt m t dt dm dt→→ ++ −− == 0 Onde, dm dt VC é a taxa de variação de massa dentro do volume de controle no tempo t. No mesmo limite, quando dt tende para zero, os termos do lado direito da Eq. 4.7-4 tornam-se respectivamente; 76
- 77. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 22 lim dt e e m dt m →→ •• == 0 δδ , lim dt s s m dt m →→ •• == 0 δδ Nesta expressão me •• e ms •• , são as taxas instantâneas de escoamento de massa na entrada e saída, respectivamente, no volume de controle. Em resumo a Eq. 4.7-4 quando dt →→ 0 é, dm dt m mVC e s== −− •• •• (4.7-5) Em geral podem existir várias localizações na superfície de controle através das quais a massa pode entrar ou sair. Assim, a Eq. 4.7-5 é reescrita introduzindo- se o somatório nos termos do lado direito da equação, como na Eq. 4.7-6 dm dt m mVC e e s s == −− •• •• ∑∑ ∑∑ ( 4.7-6) A Eq. 4.7-6 constitui a expressão geral do balanço de massa para um volume de controle, admitindo-se a hipótese de escoamento uniforme dos fluxos de massa na entrada e saída do volume de controle. Vamos considerar um outro aspecto do escoamento de massa através de uma superfície de controle. Para simplificar, admitamos que um fluido esteja escoando uniformemente no interior de um tubo ou duto como mostrado na Fig. 4.7- 3. Desejamos examinar o escoamento em termos de quantidade de massa que cruza a superfície, A durante o intervalo de tempo dt. Conforme se observa na Fig. 4.7-3, o fluido se move de uma distância dx durante esse intervalo, e portanto o volume de fluido que cruza a superfície A é Adx. Conseqüentemente a massa que atravessa a superfície A é dada por dm Adx == νν onde νν, é o volume específico do fluido, se agora, dividirmos ambos os membros dessa expressão por dt e tomarmos o limite para dt→→ 0, o resultado será: m AV•• == r νν (4.7-7) onde r V é a velocidade. Deve-se observar que este resultado, a Eq. 4.7-7, foi desenvolvido para uma superfície de controle estacionária A, e que, tacitamente admitimos que o escoamento era normal à superfície e uniforme através da superfície. Deve-se também considerar que a Eq. 4.7-7 se aplica a qualquer uma das várias correntes de escoamento que entra e sai do volume de controle , sujeito às hipóteses mencionadas. Figura 4.7-3 - escoamento através de uma superfície de controle estacionária 77
- 78. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 23 Exemplo 4.7-1 Ar está escoando no interior de um tubo de 0,2 m de diâmetro àvelocidade uniforme de 0,1 m/s. A temperatura e a pressão são 25 O C e 150 kPa. Determinar o fluxo de massa . Solução Da equação m AV•• == r νν , e usando o modelo de gás ideal para o ar, temos: νν νν== ℜℜ == ++ →→ == M T P m kg 8314 28 97 25 27315 150000 0 5704 3 , ( , ) , a área da seção transversal do tubo é: A d m== == == ππ ππ2 2 2 4 0 2 4 0 0314 ( , ) , portanto, m x kg s •• == == 0 0314 01 0 5704 0 0055 , , , , / 4.8 - Primeira Lei da Termodinâmica para o Volume de Controle Já consideramos a primeira lei da termodinâmica para um sistema, que consiste numa quantidade fixa de massa e mostramos que para um processo ela pode ser representada pela Eq. 4.2-3, isto é 1 2 2 1 1 2∑∑ ∑∑== −− ++Q E E W (4.2-3) Vimos também que, dividindo por dt, ela pode ser escrita em termos de uma equação de fluxo médio num intervalo de tempo dt, como na Eq. 4.8-1 1 2 2 1 1 2Q dt E E dt W dt ∑∑ ∑∑== −− ++ (4.8-1) A fim de escrever a primeira lei em termos de fluxo para um volume de controle, procedemos de modo análogo ao usado para deduzir a equação da conservação da massa em termos de fluxo. Na Fig. 4.8-1 vemos um sistema e um volume de controle. O sistema é formado por toda a massa inicialmente contida no volume de controle mais a massa δδme. 78
- 79. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 24 Consideremos as mudanças que ocorrem no sistema e volume de controle durante o intervalo de tempo dt. Durante esse intervalo de tempo, dt a massa δδme entra no volume de controle através da área discreta Ae e a massa δδms sai através da área discreta As. Em nossa análise admitiremos que o incremento de massa δδme tem propriedades uniformes, o mesmo ocorrendo com δδms. O trabalho total realizado pelo sistema durante o processo, δδW, é o associado às massas δδme e δδms cruzando a superfície de controle, que é comumente chamado de trabalho de fluxo, e o trabalho Wv.c que inclui todas as outras formas de trabalho, tais como associadas com eixo que atravessa a fronteira, forças de cisalhamento, efeitos elétricos, magnéticos, ou superficiais, expansão ou contração do volume de controle. Uma quantidade de calor, δδQ, atravessa a fronteira do sistema durante dt. Consideremos agora cada termo da primeira lei da termodinâmica escrita para sistema e transformemo-lo numa forma equivalente, aplicável ao volume de controle. Consideremos primeiramente o termo E2 - E1. Seja Et = energia do volume de controle no instante t Et+ dt = a energia no volume de controle no instante t+dt Então E1 = Et + eeδδme = a energia do sistema no instante t E2 = Et+ dt + esδδms = a energia do sistema no instante t+dt Portanto, E2 - E1 = Et+ δδt + esδδms - Et - eeδδme = (Et +δδt - Et) + (esδδms - eeδδme) (4-8-2) O termo (esδδms - eeδδme) representa o fluxo de energia que atravessa a superfície de controle durante o intervalo de tempo, dt, associado às massas δδms e δδme cruzando a superfície de controle. Consideremos com maior detalhe o trabalho associado às massas δδme e δδms que cruzam a superfície de controle. O trabalho é realizado pela força normal (normal àárea A) que age sobre a δδme e δδms quando estas massas atravessam a superfície de controle. Essa força normal é igual ao produto da tensão normal - σσn, pela área A. O trabalho realizado é: -σσn A dl = - σσnδδV = - σσnνν δδm (4.8-3) Uma análise completa da natureza da tensão normal, σσn, para fluidos reais, envolve a pressão estática, e efeitos viscosos e está fora do objetivo deste texto. Admitiremos, neste texto, que a tensão normal, σσn, num ponto é igual à pressão Figura 4.8-1 Diagrama esquemático para a análise de um volume de controle segundo a primeira lei mos- trando calor, trabalho e massa atra- vessando a superfície d e controle 79
- 80. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 25 estática, P, e simplesmente notaremos que esta hipótese é bastante razoável na maioria das aplicações e que conduz a resultados de boa precisão. Com essa hipótese, o trabalho realizado sobre a massa δδme para introduzi-la no volume de controle é Peννeδδme e o trabalho realizado pela massa δδms ao sair do volume de controle é Psννsδδms. Chamaremos a esses termos TRABALHO DE FLUXO. Na literatura encontramos muitos outros termos, como escoamento de energia, trabalho de introdução e trabalho de expulsão. Então, o trabalho total realizado pelo sistema durante, dt, será; δδ δδ νν δδ νν δδW W P m P mv c s s s e e e== ++ −−. ( ) (4.8-4) dividamos, agora, as Eq. 4.8-2 e 4.8-4 por dt e substituamos na primeira lei Eq. 4.8-1. Combinando os termos e rearranjando, δδ δδ νν δδ νν δδδδQ dt m dt e P E E dt m dt e P W dt e e e e t t t s s s s v c ++ ++ == −− ++ ++ ++++ ( ) ( ) . (4.8-5) Cada um dos termos de fluxo mássico dessa expressão pode ser rescrito na forma: e P u P V gZ h V gZ++ == ++ ++ ++ == ++ ++νν νν 2 2 2 2 (4.8-6) usando a definição de entalpia específica dada pela Eq. 2.2-2. Deve ser ressaltado que o aparecimento da combinação (u + Pνν) sempre que há fluxo de massa através de uma superfície de controle é a principal razão para se definir a propriedade entalpia. A sua introdução antecipada relacionada com o processo a pressão constante, foi feita para facilitar o uso das tabelas de propriedades termodinâmicas naquela altura. Utilizando-se a Eq. 4.8-6 para as massas entrando e saindo do volume de controle, a Eq. 4.8-5 torna-se δδ δδ δδ δδδδQ dt m dt h V gZ E E dt m dt h V gZ W dt e e e e t t t s s s s v c ++ ++ ++ == −− ++ ++ ++ ++++ ( ) ( ) . 2 2 2 2 (4.8-7) Para reduzir essa expressão a uma equação em termos de fluxo, consideremos o que acontece a cada um dos termos da Eq. 4.8-7 quando dt tende para zero. Os termos de calor trocado e do trabalho tornam-se quantidades associadas àtaxa de transferência, como no caso visto na seção 4.3. Analogamente as duas quantidades de massa tornam-se fluxos de massa, como na seção 4.7 e o termo de energia torna-se a taxa de variação de energia com o tempo, no volume de controle, de maneira análoga ao termo de massa na equação da conservação de massa. Adicionalmente admitimos originalmente propriedades uniformes de massa δme, que entra no volume de controle através da área Ae e fizemos uma hipótese análoga relativamente a δδms, que sai do volume de controle através da área As. Em conseqüência, ao tomarmos os limites acima mencionados as hipótese se reduzem à restrição de propriedades uniformes ao longo das áreas Ae e As num dado instante. Naturalmente as propriedades podem depender do tempo. 80
- 81. Capítulo - 4 - Fundamentos da Termodinâmica - pág. - 26 Ao se utilizar os valores limites para exprimir a equação do primeiro princípio para um volume de controle em termos de fluxo, novamente incluímos os sinais de somatório nos termos de escoamento para considera a possibilidade de haver correntes de fluxo adicionais entrando ou saindo do volume de controle e diversos pontos onde calor e trabalho são acrescidos ao volume de controle. Portanto o resultado é: Q m h gZ dE dt m h gZ Wv c e e V e v c s s V s v c e s •• •• •• •• ∑∑ ∑∑ ∑∑ ∑∑++ ++ ++ == ++ ++ ++ ++. . .( ) ( ) 2 2 2 2 (4.8-8) que é, para nossa finalidade, a expressão geral da primeira lei da termodinâmica. Em outras palavras essa equação diz que a taxa líquida de transferência de calor para o volume de controle, mais a taxa de energia que entra no mesmo como resultado da transferência de massa, é igual àtaxa de variação da energia dentro do volume de controle mais a taxa de energia que sai deste como resultado da transferência de massa, e mais a potência líquida associada a eixo, cisalhamento, efeitos elétricos e outros fatores que já foram mencionados. A Eq. 4.8-8 pode ser integrada ao longo do tempo total de um processo para se obter a variação total de energia que ocorre naquele período. Entretanto para se fazer isto é necessário o conhecimento da dependência com o tempo dos vários fluxos de massa e dos estados das massas que entram e saem do volume de controle. Um outro ponto que deve ser observado é que se não houver fluxo de massa entrando ou saindo do volume de controle, aqueles termos da Eq, 4.8-8 simplesmente desaparecem da Eq. 4.8-8, que então se reduz àequação da primeira lei para sistema fechado, em termos de fluxo, já discutida na seção 4.3, ou seja, Q dE dt W •• •• ∑∑ ∑∑== ++ (4.3-3) Como a abordagem pelo volume de controle é mais geral, e se reduz à expressão usual da primeira lei para um sistema quando não há fluxo de massa através da superfície de controle, usaremos como expressão geral da 1 a lei, a Eq, 4.8-8. 4.9 - O processo em Regime Permanente Nossa primeira aplicação das equações de volume de controle será no desenvolvimento de um modelo analítico adequado para operações em regime permanente de dispositivos como: Turbinas, Compressores, Bocais, Caldeiras, Trocadores Calor etc. , ou seja, um grupo muito grande de problemas de interesse na engenharia. Esse modelo não incluirá as fases transitória de entrada em operação e parada de tais dispositivos, abordando apenas o período de tempo de operação estável. 81
