Este documento resume as principais mudanças nas diretrizes de Suporte Avançado de Vida em Pediatria, incluindo: 1) a introdução de termos internacionais padronizados; 2) a ênfase na necessidade de melhor coleta de dados epidemiológicos; 3) recomendações atualizadas sobre ventilação, fluidoterapia, medicações e tratamento de arritmias.





![A decisão de não ressuscitar ou de limitar tais esforços, assumida pelo médico, pais
ou pela criança (quando tal direito lhe é delegado), deve ser detalhadamente notificada.
Uma prescrição médica com limites dos esforços de ressuscitação deve ser fornecida para
uso em ambientes hospitalares (em muitos países é necessário relatório separado, para o
atendimento extra-hospitalar). A regulamentação e o uso para fins legais desses relatórios
variam de país para país, e dentro dos Estados Unidos, de estado para estado, no que diz
respeito a “Ordem Oficial de Não Ressuscitar”, para uso extra-hospitalar. É muito
importante que a família informe o seu SME local, quando houver definição dessa ordem
oficial. Para maiores informações a respeito da ressuscitação ética, veja também “Parte 2:
Aspectos Éticos da RCP e CCE”.
Sempre que uma criança portadora de doença crônica ou com ameaça de vida
recebe alta do hospital, pais, enfermeiras escolares e outros profissionais da saúde devem
ser informados sobre causas possíveis de deterioração ou complicações que possam ocorrer
e sinais antecipados de piora. Eles devem receber instruções específicas sobre RCP e
outras intervenções que a criança possa necessitar e instruções sobre quem contatar e
porque.12
Se a criança tem uma traqueostomia, qualquer pessoa responsável pelo cuidado da
mesma (incluindo os pais, enfermeiras escolares e profissionais de saúde que atendem no
domicílio) deve ser instruída a avaliar se a passagem de ar está desobstruída, como
desobstruí-la e como prover RCP usando a via aérea artificial. Se a RCP for necessária,
respiração de resgate e ventilação com bolsa-máscara são executadas através do tubo de
traqueostomia. Assim como em qualquer forma de respiração de resgate, o sinal chave de
ventilação efetiva é a adequada expansão bilateral do tórax. Se a cânula de traqueostomia
estiver obstruída e tornar-se impossível a ventilação através da mesma, mesmo após
tentativas de desobstruir a passagem pelo tubo por aspiração, remova e recoloque um novo
tubo. Se um tubo limpo não estiver disponível, a ventilação pode ser executada utilizando
ventilação boca-estoma, até que uma passagem de ar artificial possa ser colocada através do
estoma. Alternativamente, se as vias aéreas superiores estiverem desobstruídas, pode ser
possível executar ventilação bolsa-máscara convencional através do nariz e boca ocluíndo-
se, superficialmente, o local da traqueostomia.
Diretrizes Internacionais do SAVP
Em seguida a implementação das diretrizes de 1992, os principais conselhos de
ressuscitarão (International Liaison Committee on Resuscitation [ILCOR]) participaram do
desenvolvimento de declarações consultivas de consenso, baseadas em diretrizes de
ressuscitação existentes, experiência prática e interpretação informal e debate sobre uma
base de dados internacional em ressuscitação.14,15
Existe um alto grau de uniformidade nas
diretrizes atuais criadas pelos maiores conselhos de ressuscitação de recentemente-
nascidos, neonatos, lactentes e crianças. A maioria das controvérsias deve-se a
preferências ou costumes locais e regionais e diferenças na disponibilidade de
equipamentos e medicações e não a diferenças na interpretação de evidências científicas.
Para desenvolver o presente documento de Diretrizes Internacionais 2000 em
SAVP, o Subcomitê em Ressuscitação Pediátrica da AHA e outros membros do ILCOR
identificaram assuntos ou novas descobertas merecedoras de avaliação em maior
profundidade. A partir dessa lista, áreas de pesquisa ativa e envolvendo controvérsias
foram identificadas; avaliação baseada em evidências em cada uma dessas áreas foi](https://image.slidesharecdn.com/suporteavanadodevidaempediatria-130920232703-phpapp02/85/Suporte-avancado-de-vida-em-pediatria-6-320.jpg)



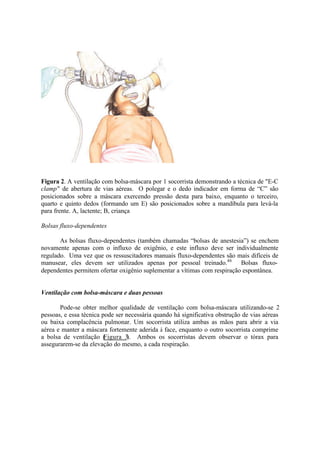
![Reconhecimento da falência respiratória e choque
A sobrevivência após uma parada cardíaca, em crianças, gira em torno de 7% a
11%, sendo que a maioria dos sobreviventes apresenta sequelas neurológicas. Por essa
razão, enfatizamos a necessidade do reconhecimento e tratamento precoce da falência
respiratória e do choque, para prevenir a ocorrência de uma parada. Para padronizar a
terminologia, utilizamos as seguintes definições do “Pediatric Utstein Style”: “parada
respiratória” é definida como a ausência de respiração (isso é, apnéia) com atividade
cardíaca detectável. Essa terminologia deve ser distinguida de comprometimento
respiratório levando à ventilação assistida. Nessa última, o doente pode apresentar
desconforto respiratório com esforço aumentado ou esforço respiratório inadequado, sem
desconforto. Parada cardíaca é a cessação da atividade mecânica cardíaca, determinada
pela incapacidade de palpar o pulso central, ausência de resposta e apnéia (isso é, ausência
de sinais de circulação ou vida).
Deterioração da função respiratória ou parada respiratória iminente podem ser
previstas em lactentes e crianças que apresentem qualquer um dos seguintes sinais:
aumento da freqüência respiratória, particularmente se acompanhadas de sinais de
desconforto ou aumento do esforço respiratório; freqüência respiratória, esforço ou
excursão torácica inadequados; diminuição dos sons respiratórios periféricos; gemidos
respiratórios ou falta de ar (gasping); diminuição do nível de consciência ou resposta
dolorosa; diminuição do tonus muscular ou cianose.
“Falência Respiratória” é o estado clínico caracterizado por oxigenação e ou
ventilação inadequadas. É difícil definir critérios rigorosos para falência respiratória
porque a oxigenação ou ventilação basal, para uma determinada criança ou lactente pode
ser anormal. Por exemplo, um lactente com doença cardíaca congênita cianogênica não
estaria em falência respiratória se tomarmos como base de referência saturação de oxigênio
de 60%, enquanto esse valor já não seria um critério apropriado para uma criança com
função fisiológica cardiopulmonar normal. Falência respiratória pode ser funcionalmente
caracterizada como o estado clínico que requer intervenção, para prevenir parada
respiratória ou cardíaca.
"Choque" é um estado clínico em que o fluxo sangüíneo e a oferta de nutrientes aos
tecido não correspondem à demanda metabólica tecidual. Choque pode ocorrer com débito
cardíaco ou pressão sangüínea aumentada, normal ou diminuída. Uma vez que o choque
representa uma progressão da gravidade, é melhor caracterizado como sendo compensado
ou descompensado. “Choque Descompensado” é definido como um estado clínico de
perfusão tecidual inadequada para manter a demanda metabólica acompanhada de
hipotensão (isso é, uma pressão sangüínea sistólica [PSS] menor que o percentil 5 para a
idade). A definição de hipotensão em neonatos pré-termo depende do peso e da idade
gestacional do recém-nascido.
Para as diretrizes do SAVP, hipotensão é caracterizada como:
• Para neonatos de termo (0 a 28 dias de idade), PSS < 60 mmHg
• Para lactentes de 1 mês a 12 meses, PSS < 70 mmHg
• Para crianças > 1 ano a 10 anos, PSS < 70 + (2x a idade em anos)
• Além de 10 anos, a hipotensão é definida como PSS < 90 mmHg](https://image.slidesharecdn.com/suporteavanadodevidaempediatria-130920232703-phpapp02/85/Suporte-avancado-de-vida-em-pediatria-10-320.jpg)

![sempre é um procedimento adequado para ser aplicado fora do cenário hospitalar,
dependendo de fatores tais como a experiência e o treinamento do socorrista e do intervalo
de tempo de transporte. Adicionalmente à condição do paciente, uma ampla variedade de
fatores do sistema do SME deve ser avaliada para identificar o melhor método de assegurar
as vias aéreas numa dada situação. Estes fatores incluem o treinamento do socorrista do
SME, a exigência de tempo de experiência para socorristas ativos, as indicações e técnicas
de intubação endotraqueal pediátrica, do SME, e os métodos utilizados para avaliar a
correta colocação do tubo. Em estudos retrospectivos, o aumento das aptidões técnicas e a
taxa reduzida de complicações foram associados a maior treinamento (incluindo tempo
gasto em supervisão nas salas de emergência, bem como em campo)17,22
emprego de
requisitos que assegurem o desenvolvimento de experiência adequada, e uso de agentes
paralisantes (curares).17,23,24
Em alguns sistemas de SME a taxa de sucesso na intubação pediátrica é
relativamente baixa e a taxa de complicação alta.25
Isso provavelmente reflete o uso
infreqüente das habilidades de intubação por paramédicos num sistema de nível único. Em
sistemas de SME de níveis, o segundo nível de socorristas pré-hospitalares deve ter
treinamento suficiente e experiência de longo prazo para intubar com segurança e de forma
efetiva.17
Equipes que se dedicam a cuidados intensivos ou que executam transporte inter-
hospitalar (incluindo equipe de transporte com helicóptero) também podem ter uma alta
taxa de sucesso com intubação orotraqueal.24,26
Inversamente, no único estudo pediátrico
prospectivo randomizado e controlado, comparando aéreo) também devem apresentar
elevada taxa de sucesso na intubação endotraqueal. ventilação com bolsa-máscara e
intubação endotraqueal no atendimento pré-hospitalar, mostrou que a ventilação com bolsa-
máscara foi tão efetiva quanto a intubação endotraqueal; para o subgrupo com falência
respiratória, a ventilação com bolsa-máscara foi associada à maior sobrevida.25
É
importante notar que os tempos de transporte até esse sistema de EMS eram curtos, todos
os socorristas receberam treinamento detalhado em ventilação com bolsa-máscara e em
intubação endotraqueal, e foram infrequentes as oportunidades dos indivíduos com preparo
em SAV de executar o intubação pediátrica. Em suma, esse estudo sugere que a intubação
endotraqueal não permite sobrevida maior quando comparada à ventilação com bolsa-
máscara, em todos os sistemas de SME, e a intubação endotraqueal parece provocar
aumento de complicações relacionadas às vias aéreas.25
Baseado nesses dados, qualquer indivíduo preparado para fornecer SBV, no
atendimento pré-hospitalar para lactentes e crianças, deve estar treinado para fornecer
efetiva oxigenação e ventilação utilizando a técnica de bolsa-máscara, como método
primário de ventilação de suporte, particularmente se o tempo de transporte for curto
(Classe IIa; nível da evidência [NE]) A intubação de um paciente pediátrico seriamente
doente ou ferido, fora do cenário hospitalar, requer tanto treinamento inicial adequado
quanto experiência contínua e mais monitoração dos resultados. Se algum sistema de SME
optar por realizar intubação endotraqueal no atendimento fora do hospital, deve assegurar
treinamento inicial apropriado, monitorização da retenção de habilidade, e seguir avaliando
a segurança e a eficácia desta intervenção.
Quando usado por socorristas adequadamente treinados, as medicações podem
aumentar a taxa de sucesso da intubação endotraqueal, mas podem introduzir riscos
adicionais. Porque o risco de um tubo mal posicionado é inaceitavelmente elevado e sinais
clínicos confirmando o posicionamento do tubo na traquéia não são completamente
confiáveis,28
o uso de um dispositivo para confirmar o posicionamento do tubo traqueal, em](https://image.slidesharecdn.com/suporteavanadodevidaempediatria-130920232703-phpapp02/85/Suporte-avancado-de-vida-em-pediatria-12-320.jpg)


























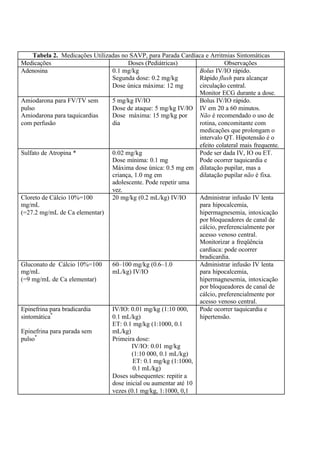



























![por minuto cronotrópico;
vasodilatador em
doses baixas e
vasopressor em
altas doses
de mg diluídas para um
total de 100 ml; assim 1
ml/h oferece 0,1 µg/kg por
minuto
Lidocaína Dose de ataque: 1 mg/kg
Infusão EV/IO: 20 a 50 µg/kg
por minuto
Antiarrítmico;
inotrópico
negativo leve.
Usar baixas taxas
de infusão se
houver baixo
débito cardíaco ou
função hepática
ruim.
60 X peso (em kg) = No.
de mg diluídas para um
total de 100 ml; assim 1
ml/h oferece 10 µg/kg por
minuto ou ajuste
alternativo 120 mg/100
ml correr em 1 a 2,5 ml/kg
por hora
Milrinona Dose de ataque: 50-75 µg/kg
Infusão EV/IO: 0,5-0,75 µg/kg
por minuto
Inodilatador 0,6 X peso (em kg) = No.
de mg diluídas para um
total de 100 ml; assim 1
ml/h oferece 0,1 µg/kg por
minuto
Norepinefrina Infusão EV/IO: 0,1-2,0 µg/kg
por minuto
Vasopressor 0,6 X peso (em kg) = No.
de mg diluídas para um
total de 100 ml; assim 1
ml/h oferece 0,1 µg/kg por
minuto
Prostaglandina E1 Infusão EV/IO: 0,05-0,1 µg/kg
por minuto
Mantém o ducto
arterioso aberto
em doença
cardíaca congênita
cianogênica.
Monitorizar para
apnéia, hipotensão
e hipoglicemia.
0,3 X peso (em kg) = No.
de mg diluídas para um
total de 50 ml; assim 1
ml/h oferece 0,1 µg/kg por
minuto
Nitroprussiato de
sódio
Infusão EV/IO: 1-8 µg/kg por
minuto
Vasodilatador
Preparar somente
em soro glicosado
6 X peso (em kg) = No. de
mg diluídas para um total
de 100 ml; assim 1 ml/h
oferece 1 µg/kg por
minuto
EV indica intravenoso; IO, intra-ósseo
* Muitas infusões podem ser calculadas através da “regra dos 6” como ilustrado na
tabela. Alternativamente, uma concentração padrão pode ser utilizada para oferecer solução
mais diluídas ou mais concentradas, mas então, uma dose individual deve ser calculada
para cada paciente e cada taxa de infusão como se segue: Taxa de infusão (ml/h) = [peso
(kg) X dose (µg/kg por minuto) X 60 min/h]/concentração (µg/ml). Os diluentes podem ser](https://image.slidesharecdn.com/suporteavanadodevidaempediatria-130920232703-phpapp02/85/Suporte-avancado-de-vida-em-pediatria-74-320.jpg)












![54. Khine HH, Corddry DH, Kettrick RG, Martin TM, McCloskey JJ, Rose JB,
Theroux MC, Zagnoev M. Comparison of cuffed and uncuffed endotracheal tubes
in young children during general anesthesia. Anesthesiology. 1997;86:627–631.
55. Luten RC, Wears RL, Broselow J, Zaritsky A, Barnett TM, Lee T, Bailey A, Valley
R, Brown R, Rosenthal B. Length-based endotracheal tube and emergency
equipment in pediatrics. Ann Emerg Med. 1992;21:900–904.
56. King BR, Baker MD, Braitman LE, Seidl-Friedman J, Schreiner MS. Endotracheal
tube selection in children: a comparison of four methods. Ann Emerg Med.
1993;22:530–534.
57. van den Berg AA, Mphanza T. Choice of tracheal tube size for children: finger size
or age-related formula? Anaesthesia. 1997;52:701–703.
58. Westhorpe RN. The position of the larynx in children and its relationship to the ease
of intubation. Anaesth Intensive Care. 1987;15:384–388.
59. Kelly JJ, Eynon CA, Kaplan JL, de Garavilla L, Dalsey WC. Use of tube
condensation as an indicator of endotracheal tube placement. Ann Emerg Med.
1998;31:575–578.
60. Donn SM, Kuhns LR. Mechanism of endotracheal tube movement with change of
head position in the neonate. Pediatr Radiol. 1980;9:37–40.
61. Hartrey R, Kestin IG. Movement of oral and nasal tracheal tubes as a result of
changes in head and neck position. Anaesthesia. 1995;50:682–687.
62. Gerardi MJ, Sacchetti AD, Cantor RM, Santamaria JP, Gausche M, Lucid W, Foltin
GL. Rapid-sequence intubation of the pediatric patient. Pediatric Emergency
Medicine Committee of the American College of Emergency Physicians [see
comments]. Ann Emerg Med. 1996;28:55–74.
63. Bota GW, Rowe BH. Continuous monitoring of oxygen saturation in prehospital
patients with severe illness: the problem of unrecognized hypoxemia. J Emerg Med.
1995;13:305–311.
64. Aughey K, Hess D, Eitel D, Bleecher K, Cooley M, Ogden C, Sabulsky N. An
evaluation of pulse oximetry in prehospital care. Ann Emerg Med. 1991;20:887–
891.
65. Brown LH, Manring EA, Kornegay HB, Prasad NH. Can prehospital personnel
detect hypoxemia without the aid of pulse oximeters? Am J Emerg Med.
1996;14:43–44.
66. Birmingham PK, Cheney FW, Ward RJ. Esophageal intubation: a review of
detection techniques. Anesth Analg. 1986;65:886–891.
67. Bhende MS, Thompson AE, Orr RA. Utility of an end-tidal carbon dioxide detector
during stabilization and transport of critically ill children. Pediatrics.
1992;89:1042–1044.
68. Bhende MS, Thompson AE, Cook DR, Saville AL. Validity of a disposable end-
tidal CO2 detector in verifying endotracheal tube placement in infants and children.
Ann Emerg Med. 1992;21:142–145.
69. Bhende MS, Thompson AE. Evaluation of an end-tidal CO2 detector during
pediatric cardiopulmonary resuscitation. Pediatrics. 1995;95:395–399.
70. Ornato JP, Shipley JB, Racht EM, Slovis CM, Wrenn KD, Pepe PE, Almeida SL,
Ginger VF, Fotre TV. Multicenter study of a portable, hand-size, colorimetric end-
tidal carbon dioxide detection device. Ann Emerg Med. 1992;21:518–523.](https://image.slidesharecdn.com/suporteavanadodevidaempediatria-130920232703-phpapp02/85/Suporte-avancado-de-vida-em-pediatria-89-320.jpg)





![154. Fiallos M, Kissoon N, Abdelmoneim T, Johnson L, Murphy S, Lu L,
Masood S, Idris A. Fat embolism with the use of intraosseous infusion during
cardiopulmonary resuscitation. Am J Med Sci. 1997;314:73–79.
155. Ward J Jr. Endotracheal drug therapy. Am J Emerg Med. 1983;1:71–82.
156. Johnston C. Endotracheal drug delivery. Pediatr Emerg Care. 1992;8:94–97.
157. Ralston SH, Tacher WA, Showen L, Carter A, Babbs CF. Endotracheal
versus intravenous epinephrine during electromechanical dissociation with CPR in
dogs. Ann Emerg Med. 1985;14:1044–1048.
158. Kleinman ME, Oh W, Stonestreet BS. Comparison of intravenous and
endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets.
Crit Care Med. 1999;27:2748–2754.
159. Quinton DN, O’Byrne G, Aitkenhead AR. Comparison of endotracheal and
peripheral intravenous adrenaline in cardiac arrest: is the endotracheal route
reliable? Lancet. 1987;1:828–829.
160. Jasani MS, Nadkarni VM, Finkelstein MS, Mandell GA, Salzman SK,
Norman ME. Endotracheal epinephrine administration technique effects in pediatric
porcine hypoxic-hypercarbic arrest. Crit Care Med. 1994;22:1174–1180.
161. Lubitz DS, Seidel JS, Chameides L, Luten RC, Zaritsky AL, Campbell FW.
A rapid method for estimating weight and resuscitation drug dosages from length in
the pediatric age group. Ann Emerg Med. 1988;17:576–581.
162. Carcillo J, Davis A, Zaritsky A. Role of early fluid resuscitation in pediatric
septic shock. JAMA. 1991;266:1242–1245.
163. Schierhout G, Roberts I. Fluid resuscitation with colloid or crystalloid
solutions in critically ill patients: a systematic review of randomised trials. BMJ.
1998;316:961–964.
164. Cochrane Injuries Group Albumin Reviewers. Human albumin
administration in critically ill patients: systematic review of randomised controlled
trials. BMJ. 1998;317:235–240.
165. Qureshi AI, Suarez JI, Bhardwaj A, Mirski M, Schnitzer MS, Hanley DF,
Ulatowski JA. Use of hypertonic (3%) saline/acetate infusion in the treatment of
cerebral edema: effect on intracranial pressure and lateral displacement of the brain.
Crit Care Med. 1998;26:440–446.
166. Schwarz S, Schwab S, Bertram M, Aschoff A, Hacke W. Effects of
hypertonic saline hydroxyethyl starch solution and mannitol in patients with
increased intracranial pressure after stroke. Stroke. 1998;29:1550–1555.
167. Rocha e Silva M. Hypertonic saline resuscitation. Medicina. 1998;58:393–
402.
168. Simma B, Burger R, Falk M, Sacher P, Fanconi S. A prospective,
randomized, and controlled study of fluid management in children with severe head
injury: lactated Ringer’s solution versus hypertonic saline [see comments]. Crit
Care Med. 1998;26:1265–1270.
169. Cherian L, Goodman JC, Robertson CS. Hyperglycemia increases brain
injury caused by secondary ischemia after cortical impact injury in rats [see
comments]. Crit Care Med. 1997;25:1378–1383.
170. Ashwal S, Schneider S, Tomasi L, Thompson J. Prognostic implications of
hyperglycemia and reduced cerebral blood flow in childhood near-drowning.
Neurology. 1990;40:820–823.](https://image.slidesharecdn.com/suporteavanadodevidaempediatria-130920232703-phpapp02/85/Suporte-avancado-de-vida-em-pediatria-95-320.jpg)













![383. Haddad LM. Resuscitation after nifedipine overdose exclusively with
intravenous calcium chloride. Am J Emerg Med. 1996;14:602–603.
384. Horowitz BZ, Rhee KJ. Massive verapamil ingestion: a report of two cases
and a review of the literature. Am J Emerg Med. 1989;7:624–631.
385. Watling SM, Crain JL, Edwards TD, Stiller RA. Verapamil overdose: case
report and review of the literature. Ann Pharmacother. 1992;26:1373–1378.
386. American Academy of Pediatrics Committee on Drugs. Naloxone dosage
and route of administration for infants and children: addendum to emergency drug
doses for infants and children. Pediatrics. 1990;86:484–485.
387. Sporer KA, Firestone J, Isaacs SM. Out-of-hospital treatment of opioid
overdoses in an urban setting. Acad Emerg Med. 1996;3:660–667.
388. Yealy DM, Paris PM, Kaplan RM, Heller MB, Marini SE. The safety of
prehospital naloxone administration by paramedics. Ann Emerg Med. 1990;19:902–
905.
389. Mills CA, Flacke JW, Flacke WE, Bloor BC, Liu MD. Narcotic reversal in
hypercapnic dogs: comparison of naloxone and nalbuphine. Can J Anaesth.
1990;37:238–244.
390. Prough DS, Roy R, Bumgarner J, Shannon G. Acute pulmonary edema in
healthy teenagers following conservative doses of intravenous naloxone.
Anesthesiology. 1984;60:485–486.
391. Osterwalder JJ. Naloxone: for intoxications with intravenous heroin and
heroin mixtures: harmless or hazardous? A prospective clinical study. J Toxicol Clin
Toxicol. 1996;34:409–416.
392. Kienbaum P, Thurauf N, Michel MC, Scherbaum N, Gastpar M, Peters J.
Profound increase in epinephrine concentration in plasma and cardiovascular
stimulation after mu-opioid receptor blockade in opioid-addicted patients during
barbiturate-induced anesthesia for acute detoxification [see comments].
Anesthesiology. 1998;88:1154–1161.
393. American Academy of Pediatrics Committee on Drugs. Emergency drug
doses for infants and children with naloxone in newborns: clarification. Pediatrics.
1989;83:803.
394. Wanger K, Brough L, Macmillan I, Goulding J, MacPhail I, Christenson JM.
Intravenous vs subcutaneous naloxone for out-of-hospital management of presumed
opioid overdose. Acad Emerg Med. 1998;5:293–299.
395. Rosen P, Stoto M, Harley J. The use of the Heimlich maneuver in near
drowning: Institute of Medicine report. J Emerg Med. 1995;13:397–405.
396. Quan L, Wentz KR, Gore EJ, Copass MK. Outcome and predictors of
outcome in pediatric submersion victims receiving prehospital care in King County,
Washington. Pediatrics. 1990;86:586–593.
397. Spack L, Gedeit R, Splaingard M, Havens PL. Failure of aggressive therapy
to alter outcome in pediatric near-drowning. Pediatr Emerg Care. 1997;13:98–102.
398. Lavelle JM, Shaw KN. Near drowning: is emergency department
cardiopulmonary resuscitation or intensive care unit cerebral resuscitation
indicated? Crit Care Med. 1993;21:368–373.
399. Bohn DJ, Biggar WD, Smith CR, Conn AW, Barker GA. Influence of
hypothermia, barbiturate therapy, and intracranial pressure monitoring on morbidity
and mortality after near drowning. Crit Care Med. 1986;14:529–534.](https://image.slidesharecdn.com/suporteavanadodevidaempediatria-130920232703-phpapp02/85/Suporte-avancado-de-vida-em-pediatria-109-320.jpg)


