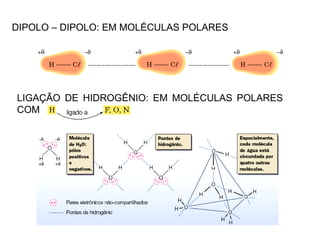
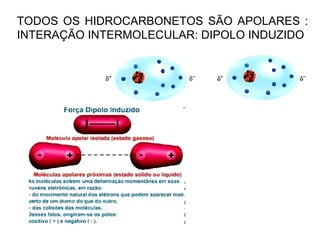
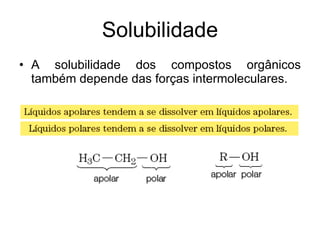
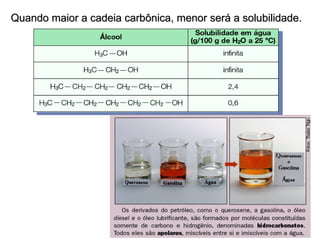
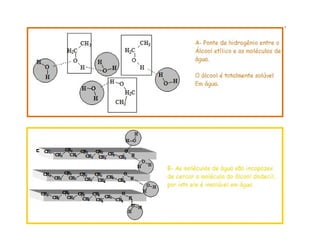
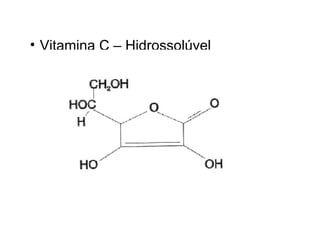
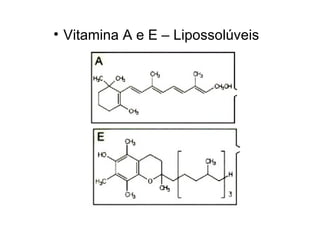
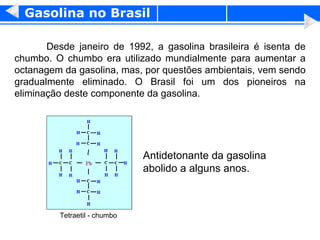
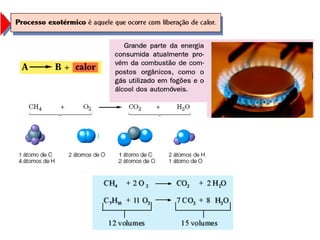
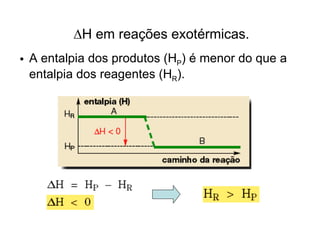
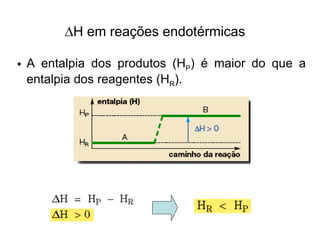
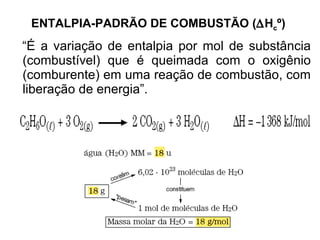
1) O documento discute propriedades físicas e químicas de hidrocarbonetos encontrados no petróleo e suas aplicações.
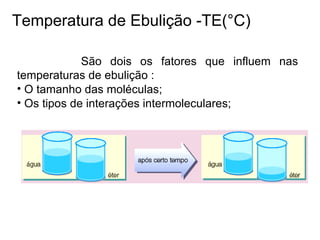
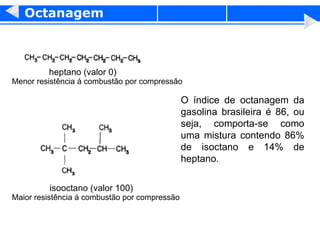
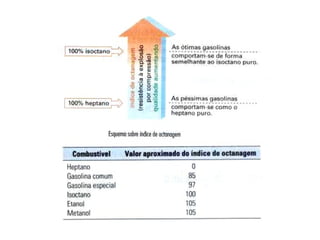
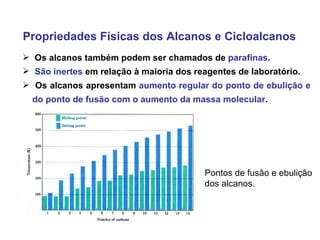
2) A temperatura de ebulição de hidrocarbonetos aumenta com o tamanho da cadeia carbônica e diminui com ramificações.
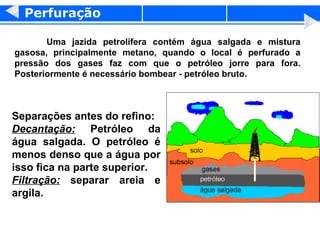
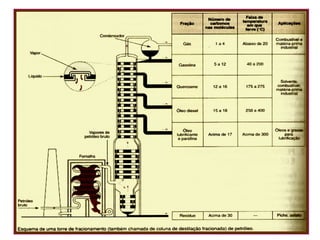
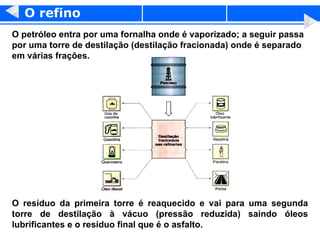
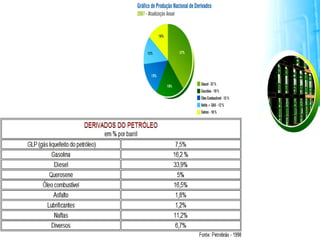
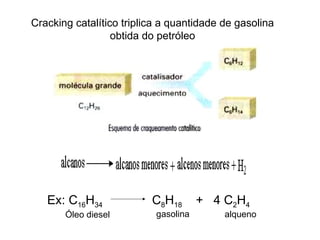
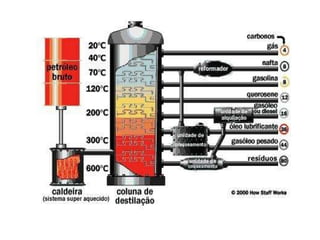
3) O refino do petróleo envolve destilação fracionada para separar as frações em gasolina, diesel, querosene e outros produtos.