1) O documento descreve a evolução do modelo atômico desde Dalton até o modelo atômico moderno, com mudanças propostas por Thomson, Rutherford e Bohr.
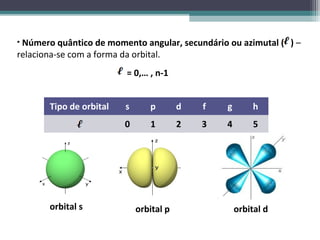
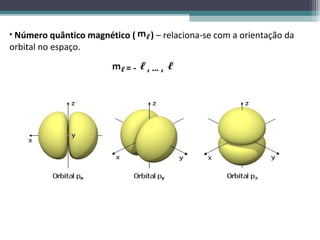
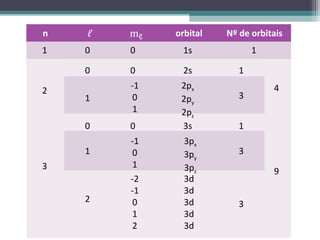
2) Explica os principais conceitos do modelo atômico atual, incluindo o núcleo, os elétrons e seus números quânticos.
3) Detalha as regras para preenchimento das orbitais eletrônicas em um átomo, resultando na configuração eletrônica em seu estado fundamental.