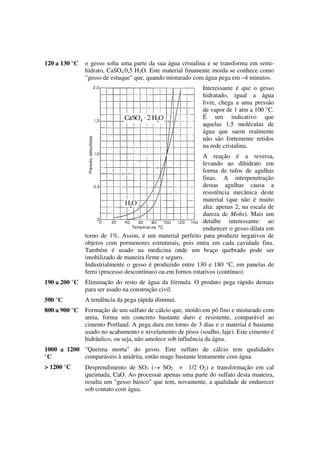
O documento aborda a produção de cimentos e argamassas não-hidráulicas, focando em gesso e cal apagada. O gesso, derivado do sulfato de cálcio, é utilizado em diversas aplicações, incluindo medicina e construção, enquanto a cal apagada, obtida da calcinação do calcário, é uma base fundamental na indústria. A predominância do cimento Portland é atribuída à velocidade de seu endurecimento em comparação com a argamassa à base de cal.