1. O documento discute a definição de minerais, classificação de minerais com base em sua composição química e abundância relativa dos principais minerais na crosta terrestre.
2. Os minerais são definidos como sólidos naturais com estrutura cristalina e composição química definida. Eles são classificados em não silicatos e silicatos.
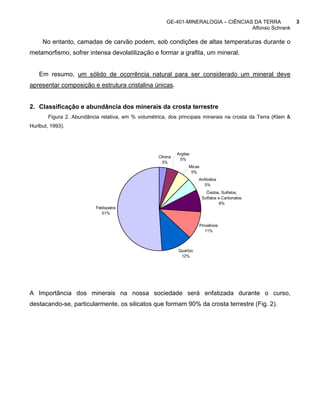
3. Os silicatos mais abundantes na crosta terrestre são feldspatos, quartzo e micas.
![GE-401-MINERALOGIA – CIÊNCIAS DA TERRA 1
Alfonso Schrank
MINERAIS: CONCEITO, CLASSIFICAÇÃO, ABUNDÂNCIA E AMBIENTES DE
FORMAÇÃO.
1. O conceito de mineral
Com base no raio iônico dos elementos mais abundantes, como a crosta terrestre pode ser
visualizada quimicamente?
O O2- compreende mais de 90% do volume total ocupado pelos íons dos elementos na
crosta, pois apresenta um raio iônico maior, comparado com os outros íons dos elementos
mais comuns. Dessa forma, a crosta terrestre pode ser visualizada como um empacotamento
de ânions O2-, com os cátions presentes nos interstícios, formando particularmente
compostos de O2- e Si4+, denominados de silicatos.
Silicatos, juntamente com óxidos, sulfetos, sulfatos, carbonatos, etc., ocorrem sob a forma de
sólidos denominados de minerais.
Minerais são definidos como:
1. Sólidos de ocorrência natural e resultado de processos inorgânicos. Um mineral que se
forma apenas através de síntese artificial não é um mineral por definição. O termo
inorgânico serve apenas para excluir hidrocarbonetos e outras moléculas onde o carbono
é o constituinte principal. Note que apatita [Ca5(PO4)3(OH)], calcita, grafita, e pirita (FeS2)
são minerais que podem ter sido precipitados a partir de processos biogênicos. A flúor-
apatita [Ca5(PO4)3(OH,F)], por exemplo, é o principal constituinte dos dentes e ossos do
corpo humano. Conchas marinhas também são constituídas por minerais embora a
aragonita (CaCO3) seja formada por processos biogênicos, como o nosso esqueleto.
2. Caracterizados por uma fase homogênea, ou seja, não podem ser separadas por meios
mecânicos em duas ou mais substâncias com propriedades físicas ou químicas distintas.
3. Com estrutura interna caracterizada por um arranjo atômico que se repete de forma
organizada tridimensionalmente, ou seja, apresentam estrutura cristalina (Fig. 1). Cristal é](https://image.slidesharecdn.com/conceitoapostila-100320174858-phpapp02/75/Conceito-Apostila-Geologia-1-2048.jpg)

![GE-401-MINERALOGIA – CIÊNCIAS DA TERRA 4
Alfonso Schrank
Os minerais podem ser divididos em classes com base na composição química,
particularmente no ânion ou grupo aniônico dominante. De forma simplificada dividiremos os
minerais em não silicatos e silicatos.
NÃO SILICATOS
Elementos Nativos Aproximadamente 20 elementos são encontrados no
seu estado nativo. Au, Ag, Cu e Pt; As e Bi (raros);
enxofre, diamante e grafita.
Sulfetos Inclui uma grande parte de minerais de minério. XmSn,
onde X= elemento metálico. Pirita (FeS2); calcopirita
(CuFeS2); bornita (Cu2S); covelita (CuS); galena (PbS);
esfalerita (ZnS); molibdenita (MoS2).
Metais ou semi-metais tomam o lugar do enxofre na
estrutura. Enargita (Cu3AsS4); tetraedrita (Cu12Sb4S13);
sulfo-sais
arsenopirita (FeAsS). Existem cerca de 100 sulfo-sais,
mas apenas alguns são importantes.
Contêm os elementos halogênios F, Cl, Br, and I como
ânions dominantes. Combinam-se geralmente com
Haletos
cátions de elementos alcalinos e alcalinos terrosos (Na,
K, and Ca). Halita (NaCl) (sal de cozinha) and fluorita
(CaF2).
X2O: cuprita – Cu2O.
X2O3: Grupo da hematita → coríndon (Al2O3); hematita
(Fe2O3); ilmenita (FeTiO3).
Óxidos XO2: Grupo do rutilo → rutilo (TiO2); pirolusita (MnO2);
cassiterita (SnO2); uraninita (UO2).
XY2O4: Grupo do espinélio → espinélio (MgAl2O4);
magnetita (Fe3O4); cromita (FeCr2O4).
Estes minerais contêm OH- como o ânion dominante.
Hidróxidos Brucita [Mg(OH)2]; Gibbisita [Al(OH)3]; bauxita (hidróxido
de Al e Fe hidratado).](https://image.slidesharecdn.com/conceitoapostila-100320174858-phpapp02/85/Conceito-Apostila-Geologia-4-320.jpg)
![GE-401-MINERALOGIA – CIÊNCIAS DA TERRA 5
Alfonso Schrank
Apresentam CO32- como o ânion dominante. Grupo da
Carbonatos calcita → calcita (CaCO3); magnesita (MgCO3); siderita
(FeCO3); rodocrosita (MnCO3); Grupo da aragonita →
aragonita (CaCO3); cerussita (PbCO3); Grupo da
dolomita → dolomita [CaMg(CO3)2]; ankerita
[CaFe(CO3)2]; Carbonatos hidratados → malaquita
[Cu2CO3(OH)2]; azurita [Cu3(CO3)2(OH)2.
Lançar no diagrama FeO MgO CaO T
a análise química 12,06 12,85 29,23 54,14
deste carbonato: Calcita x y z 100
FeO 12,6 % em peso CaCO3 x= (12,06/54,14)x 100=22,29
MnO 0,77 Y= 23,73
MgO 12,85 Z= 53,98
CaO 29,23
CO2 43,95
Tot. 100,07
53,98
Dolomita Ankerita
CaMgCO3 CaFeCO3
MgCO3 22,29 23,73 FeCO3
Siderita
Magnesita
Figura 3. Possibilidades de solução sólida em minerais do grupo dos carbonatos (Klein & Hurlbut, 1993).
Exercício: Lançar no diagrama: Feo: 0,22% MgO 21,12% CaO 31,27% CO2 47,22%.](https://image.slidesharecdn.com/conceitoapostila-100320174858-phpapp02/85/Conceito-Apostila-Geologia-5-320.jpg)
![GE-401-MINERALOGIA – CIÊNCIAS DA TERRA 6
Alfonso Schrank
Contêm o SO42- como o ânion predominante. Barita
Sulfatos
(BaSO4); gipsita (CaSO4. 2H2O).
Os fosfatos apresentam o grupo aniônico PO43- como o
dominante. A apatita [Ca5(PO4)3(OH)], é o principal
Fosfatos, fosfato. Compostos do tipo arsenatos AsO43-, vanadatos
vanadatos, VO43- e wolframatos WO43- são estruturalmente e
etc ... quimicamente similares. Wolframita ([(Fe,Mn)WO4;
scheelita (CaWO4).
SILICATOS
Os silicatos podem ser sub-divididos de acordo com a estrutura cristalina e composição
química e apenas alguns dos principais silicatos formadores de rocha encontram-se listados
abaixo.
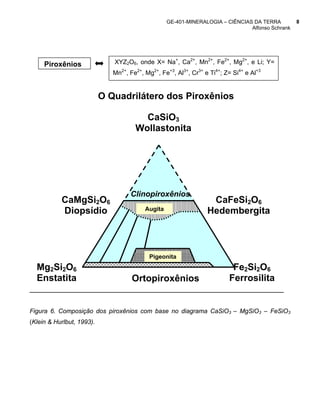
Olivina faialita - FeSiO4; forsterita - MgSiO4
Ca2SiO4
Porcentagem
molecular
CaMgSiO4 CaFeSiO4
Monticelita Kirschenita
Série
completa
MgSiO4 FeSiO4
Forsterita Faialita
Figura 4. Composição da olivina com base no diagrama CaO-MgO-FeO-SiO2 (Klein &
Hurlbut, 1993)](https://image.slidesharecdn.com/conceitoapostila-100320174858-phpapp02/85/Conceito-Apostila-Geologia-6-320.jpg)