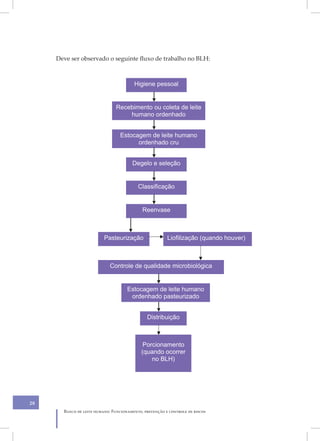
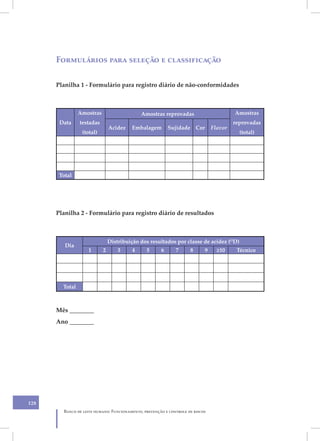
Este documento apresenta as diretrizes para o funcionamento, prevenção e controle de riscos em bancos de leite humano. Ele aborda tópicos como organização do banco de leite, infraestrutura física, equipamentos, higiene, processamento do leite, controle de qualidade e distribuição, com foco na prevenção de riscos à saúde. O objetivo é fornecer orientações técnicas para assegurar a segurança do processamento e administração do leite humano.




























































































































































![OPAS (ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE). Evidências científicas dos
dez passos para o sucesso no aleitamento materno. Tradução: Maria Cristina Gomes do
Monte. WHO/CHD/98.9. Brasília, 2001.
ORTOLANI, F. P. B, et al. Unidade de Alimentação e Nutrição, dietas enterais e lac-
tário. In: FERNANDES, A. T.; FERNANDES, M. O. V.; RIBEIRO FILHO, N. Infecção
hospitalar e suas interfaces na área da saúde. São Paulo: Atheneu, 2000. v. 2.
ROBBINS, S. T.; BEKER, L. T. Infant feedings: guidelines for preparation of formula and
breast-milk in health care facilities. Chicago: American Dietetic Association, 2004. 122 p.
ROCHA, L. C. M. et al. Serviço de Nutrição e Dietética e lactário. In: COUTO, R.
C.; PEDROSA, T. M. G.; NOGUEIRA, J. M. Infecção hospitalar e outras complicações
não-infecciosas da doença: epidemiologia, controle e tratamento. 3. ed. Rio de Janeiro:
MEDSI, 2003. 904 p.
SCHANLER, R. J. Novos conceitos na nutrição de recém-nascidos pré-termos. In:
CONGRESSO BRASILEIRO DE PERINATOLOGIA, 17, 2001, Florianópolis. Anais.
Florianópolis: [s.n.], nov. 2001.
SCHMITZ, E. M. A enfermagem em pediatria e puericultura. São Paulo: Atheneu, 2000.
477 p.
SILVA, V. G. Normas técnicas para banco de leite humano: uma proposta para subsidiar a
construção para Boas Práticas. Tese (Doutorado em Saúde da Mulher e da Criança) –
Instituto Fernandes Figueira/Fundação Oswaldo Cruz, Rio de Janeiro, 2004.
VAIN, N. Peculiaridades nutricionais do recém-nascido de muito baixo peso. In:
CONGRESSO BRASILEIRO DE PERINATOLOGIA, 17, 2001, Florianópolis. Anais.
Florianópolis: [s.n.], nov. 2001.
ZIEGLER, E. E. Breast-milk fortification. Acta Paediatr, Stockholm, v. 90, n. 7, p. 720-723,
July 2001.
159
Anvisa](https://image.slidesharecdn.com/blhanv2008-110803193231-phpapp02/85/Banco-de-leite-humano-anvisa-2008-159-320.jpg)
