1ª lei da termodinâmica
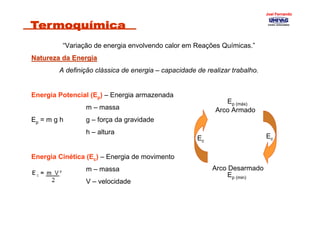
- 1. “Variação de energia envolvendo calor em Reações Químicas.” Natureza da EnergiaNatureza da Energia A definição clássica de energia – capacidade de realizar trabalho. Energia Potencial (Ep) – Energia armazenada m – massa Ep = m g h g – força da gravidade h – altura Energia Cinética (Ec) – Energia de movimento m – massa V – velocidade Arco Armado Arco Desarmado Ec Ep (máx) Ec Ep (min) Joel FernandoJoel Fernando
- 2. “Ao tratar de átomos, a força gravitacional se torna desprezível, assim, a energia potencial de maior importância para a química é a Energia Eletrostática (Eelet).” K – 8,99.109 Jm/c² Q – Carga d – Distância de Ligação Quando as cargas são de mesma natureza elétrica (sinais iguais) Eelet > 0 (Repulsão) Quando as cargas são de natureza elétrica distintas (sinais diferentes) Eelet < 0 (Atração) Joel FernandoJoel Fernando
- 3. Unidades de EnergiaUnidades de Energia Joule (J) Lembrando que “F = m.a” N = kg.ms-2 Então, J = Nm Caloria (cal) ≠ Caloria Nutricional (Cal) Na reação de síntese entre gás hidrogênio com o gás oxigênio formando água (no estado gasoso), são liberados 483,6 kJ de calor (energia térmica em movimento). a) Qual a quantidade de calorias liberadas nesse processo? b) Qual a quantidade de calorias liberadas para formação de 162g de água? Joel FernandoJoel Fernando
- 4. Sistema e VizinhanSistema e Vizinhanççaa Universo – Todo Sistema – Parte do Universo limitada e bem definida. Vizinhança – Parte não pertencente ao sistema. Ampliação Universo Sistema Vizinhança Joel FernandoJoel Fernando
- 5. Transferência de Energia (Trabalho e Calor)Transferência de Energia (Trabalho e Calor) A transferência de energia pode causar mudança na temperatura (Calor) ou movimento (trabalho). Trabalho (w) – Medida da energia que provoca deslocamento. w = F x d F – força d – distância Calor (q) – Energia que passa espontaneamente de um corpo mais quente para um corpo mais frio com o objetivo de atingir o equilíbrio térmico. “Energia térmica em movimento.” Condição Corpos/meios com temperaturas diferentes em contato. Equilíbrio térmico – Quando não há mais troca de calor entre um corpo/meio e outro, ou seja, eles estão com temperaturas iguais. Joel FernandoJoel Fernando
- 6. Sensação térmica “Relativo ao ganho ou a perda de calor (q)” Quando o calor é perdido para sua vizinhança (q < 0) - FRIO Quando a vizinhança fornece calor ao sistema (q > 0) - QUENTE Sistema Vizinhança q Sistema Vizinhança q Joel FernandoJoel Fernando
- 7. CalorimetriaCalorimetria “Medida do fluxo de calor .” Capacidade Calorífica ou calor específico (c) – É a quantidade de calor necessário para elevar a temperatura de dado material em 1 °C. Quando a capacidade calorífica está em função de 1 mol de substância, é chamada de capacidade calorífica molar ( ). Exemplos: cCO2(g) = 0,84 J g-1 K-1; cCH4(g) = 2,20 J g-1 K-1. Joel FernandoJoel Fernando
- 8. Calorímetro – Aparelho utilizado para medir o fluxo de calor. Temperatura – Grau de agitação médio das partículas. Corpo mais energético Corpo menos energético Joel FernandoJoel Fernando
- 9. TermodinâmicaTermodinâmica “É o estudo das energias e suas transformações.” 1ª Lei da Termodinâmica – Conservação das Energias A energia interna (E) do sistema consiste na somatória de toda energia cinética e potencial de todos os componentes do sistema. H2(g) + O2(g) Quando a ∆E > 0, o sistema ganhou energia Quando a ∆E < 0, o sistema perdeu energia ∆E = Efinal – Einicial H2O(l) Em uma reação química, quando o ∆E < 0, os produtos possuem energia interna menor que os reagentes. ∆E = Eprodutos – Ereagentes A energia interna muda com a adição ou perda de calor (q) e também muda quando o trabalho realizado pelo sistema ou no sistema. ∆E < 0∆E > 0 Joel FernandoJoel Fernando
- 10. Então, a energia interna é a somatória entre o calor cedido ou adquirido pelo sistema e o trabalho realizado pelo sistema ou no sistema. Relacionando variação de energia interna (∆∆∆∆E), calor (q) e trabalho (w) ∆E = q + w q – calor w – trabalho E, q e w são coordenadas termodinâmicas. Sistema Vizinhança q (q > 0) q (q < 0) w (w < 0) w (w > 0) Joel FernandoJoel Fernando
- 11. ∆E < 0w < 0 (s v)q < 0 (s v) ∆E depende dos valores absolutos de q e w. w > 0 (v s)q < 0 (s v) ∆E depende dos valores absolutos de q e w. w < 0 (s v)q > 0 (v s) ∆E > 0w > 0 (v s)q > 0 (v s) Considerando “v = vizinhança” e “s = sistema”, pode-se construir um quadro comparativo entre as coordenadas termodinâmica: E, q e w. Onde: Processos Endotérmicos e Processos Exotérmicos Processos endotérmicos são aqueles que absorvem calor (q > 0) / (∆E > 0) Processos exotérmicos são aqueles que liberam calor (q < 0) / (∆E < 0) Joel FernandoJoel Fernando
- 12. Funções de Estado Definido pela especificação de uma condição para o sistema em relação as coordenadas termodinâmicas intensivas, independente da sua evolução ao longo do tempo. Neste contexto, não se considera o histórico do sistema. Ex: Temperatura (T), Energia interna (E), Entalpia (H) Entalpia (H) É uma grandeza que informa a quantidade de energia de um dado sistema que poderia ser transformada em calor nas mudanças químicas que ocorrem à pressão constante. q = E + w w = F x d considerando um sistema de gás em um cilindro deslocando um embolo: d = ∆h F α p p = F / A portanto: F = p x A Assim, w = p A ∆h w = p ∆V qdo (s v) w < 0, logo w =w = -- pp∆∆∆∆∆∆∆∆VV H = E + pV Joel FernandoJoel Fernando
- 13. Entalpia (H) É uma grandeza que informa a quantidade de energia de um dado sistema que poderia ser transformada em calor nas mudanças químicas que ocorrem à pressão constante. q = E + w w = -p∆V H = E + pV Sendo uma função de estado, “H” só depende do estado inicial e final. Se Hfinal – Hinicial definem a ∆H ∆∆∆∆∆∆∆∆H =H = ∆∆∆∆∆∆∆∆E +E + pp∆∆∆∆∆∆∆∆VV A relação entre variação de entalpia e calor é limitado à pressão constante! ∆H = qp Então, Se ∆H > 0 O processo é Endotérmico, pois q > 0 Se ∆H < 0 O processo é Exotérmico, pois q < 0 -w = p∆∆∆∆V ∆∆∆∆∆∆∆∆H =H = ∆∆∆∆∆∆∆∆E +E + pp∆∆∆∆∆∆∆∆VV∆∆∆∆∆∆∆∆H =H = ∆∆∆∆∆∆∆∆E +E + --ww∆∆∆∆∆∆∆∆H =H = ∆∆∆∆∆∆∆∆EE -- ww∆∆∆∆∆∆∆∆H =H = ∆∆∆∆∆∆∆∆EE -- ww ∆∆∆∆∆∆∆∆EE = q + w= q + w ∆∆∆∆∆∆∆∆H =H = q + wq + w -- ww∆∆∆∆∆∆∆∆H = qH = q Joel FernandoJoel Fernando
- 14. Variação de Entalpia (H) Indica a quantidade de calor trocado por um sistema à pressão constante, quando nenhuma forma de trabalho é realizado a não ser p∆V. A entalpia que acompanha uma reação é a ∆∆∆∆∆∆∆∆HrHr.. Joel FernandoJoel Fernando
- 15. Entalpia de Reação (∆∆∆∆Hr) Também chamada de calor de reação. ∆Hr = Hprodutos – Hreagentes 2 H2(g) + O2(g) 2 H2O(g) ∆H = -483,6 kJ H Caminho da Reação 2 H2O(g) 2 H2(g)+ O2(g) ∆Hr Joel FernandoJoel Fernando
- 16. A entalpia de reação depende da quantidade de reagente consumido no processo. 2 H2(g) + O2(g) 2 H2O(g) ∆Hr = -483,6 kJ H2(g) + ½O2(g) H2O(g) ∆Hr = -242 kJ A entalpia é igual em valores absolutos, porém oposta em sinais para ∆Hr de da reação inversa. CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l) ∆Hr = - 890 kJ CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l) ∆Hr = + 890 kJ A entalpia depende do estado físico dos reagentes. CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l) ∆Hr = - 890 kJ CH4(g) + 2 O2(g) CO2(g) + 2 H2O(g) ∆Hr = - 802 kJ H2O(l) H2O(g) ∆Hr = + 44kJ Joel FernandoJoel Fernando
- 17. A entalpia de reação não é o único fator que deve ser considerado para verificar a espontaneidade de uma reação, mas de modo geral, existe uma grande tendência em: ∆H > 0 Reação não espontânea (segue o sentido inverso à formação de produtos). ∆H < 0 Reação espontânea (segue o sentido direto à formação de produtos). Lei de Hess Devido a variação de entalpia ser uma função de estado, pode-se determinar a variação de entalpia do sistema pela somatória das etapas. ∆Hr = Σ∆Hn Exemplo: Combustão incompleta do C(s) C (s) + O2(g) CO2(g) ∆Hr = -393,5 kJ CO (g) + ½ O2 CO2(g) ∆Hr = - 283,0 kJCO (g) + ½ O2 CO2(g) ∆Hr = + 283,0 kJ C(s) + ½ O2(g) CO(g) ∆Hr = -110,5 kJ Joel FernandoJoel Fernando
- 18. Entalpia de Formação (∆∆∆∆Hf) Indica a variação de entalpia em uma reação para formação de uma substância a partir de seus elementos. A entalpia de formação de qualquer elemento é zero, pois não existe uma reação de formação. No estado padrão, a ∆Hf foi calculada para 1 mol da substância formada sob temperatura de 298K e pressão atmosférica. ∆Hf ∆∆∆∆∆∆∆∆HH°°ff 2 C (grafite) + 3 H2 (g) + ½ O2 (g) C2H5OH (l) ∆H°f = -277,7 kJ Os valores de ∆H°f são tabelados, de modo que podemos utilizar esses valores para calcular a entalpia de diversas reações (∆H°r) pela aplicação da Lei de Hess. ∆H°r = Σn∆H°f (produtos) - Σn∆H°f (reagentes) Joel FernandoJoel Fernando
- 19. ∆H°r = Σn∆H°f (produtos) - Σn∆H°f (reagentes) Exemplo: Combustão incompleta do C(s) 1 C (s) + ½ O2 (g) 1 CO (g) ∆H°r = -110,5 kJ ∆H°f C(s) = 0 kJmol-1 (substância simples) ∆H°f O2 (g) = 0 kJmol-1 (substância simples) ∆H°f CO (g) = -110,5 kJmol-1 ∆H°f = [(1 x ∆H°f CO (g))] – [(1 x ∆H°f C (s) ) + (½ x ∆H°f O2)] ∆H°f = [(1 x -110,5 kJmol-1)] – [(1 x 0 kJmol-1)+(½ x 0 kJmol-1)] ∆H°f = [-110,5kJmol-1]-[0 kJmol-1] ∆H°f = -110,5 kJ Joel FernandoJoel Fernando
- 20. Quando a entalpia de reação é calculada para uma reação de combustão, pode-se chamar de entalpia de combustão (∆Hc). C (s) + ½ O2 (g) CO (g) ∆H°c = -110,5 kJ Energia de Ligação O valor médio da variação de entalpia da reação em que um mol de ligações é quebrado, estando reagentes e produtos no estado gasoso. A quebra de uma ligação é um processo endotérmico A formação de uma ligação é um processo exotérmico Eteno + H2 Etano + 2696 kJmol-1 - 2820 kJmol-1 ∆H°r = -124 kJmol-1 Ligação ∆Hl (kJmol-1) C – C 348 C – H 412 C = C 612 H – H 436 Joel FernandoJoel Fernando
