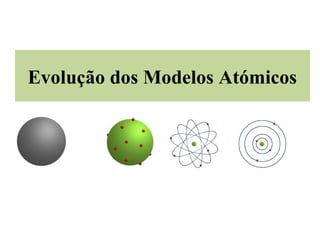
Evolução dos Modelos Atómicos: de Dalton a Bohr
- 1. Evolução dos Modelos Atómicos
- 2. Modelo Atómico de Dalton John Dalton (químico inglês) propôs o primeiro Modelo Atómico, em 1807. O átomo era rígido, maciso indivisível, indestrutível e tinha uma forma esférica. Atomo de Dalton não tinha Carga elétrica. John Dalton (1766-1844)
- 3. Modelo Atómico de Thomson Em 1904, Thomson, propôs um novo modelo (Modelo Atómico de Thomson). Admitiu que o átomo era uma esfera maciça de carga positiva, estando os electrões dispersos no seu interior. (tal como as passas num pudim). Modelo do “ Pudim de passas”. Joseph Thomson (1856-1940)
- 4. Modelo Atómico de Rutherford Rutherford (1871-1937) 1.A grande maioria dos raios α passou pela lâmina. 2. Foram poucos os raios α reflectidos pela lâmina. 3. Pouquíssimos raios α passaram pela lâmina sofrendo desvio.
- 5. Modelo Atômico de Rutherford Legenda Partícula alfa 2 4 α Próton Nêutron
- 6. Representação macroscópica Lâmina de ouro + + + ++ + + + + + + + + + + + - - - - - - - - + + + + + + -- - - - -+ + + + + +- - - - - - - - - - + + + + ++ ++ ++ + + ++ + + + + ++ + + Representação microscópica Legenda + Partícula alfa 2 4 α Próton Nêutron ++
- 7. A maior parte do espaço do átomo é espaço vazio. No seu interior, existe uma pequena região central positiva (núcleo). No núcleo encontra-se a maior parte da massa do átomo. Os electrões giram à volta do núcleo em órbitas circulares. Também conhecido como o modelo Planetário.
- 8. Conclusões • Não é maciço. Possui espaços vazios. • A maior parte da massa está em uma pequena região (núcleo) dotada de carga positiva (prótons). • Os elétrons estão girando ao redor do núcleo (eletrosfera).
- 9. • Como o modelo atômico de Rutherford não explicava o efeito eletromagnético, ou seja uma carga elétrica em movimento gera corrente eletromagnética.
- 10. Modelo Atómico de Bohr Concebido, em 1913, por Bohr. (físico dinamarquês) O átomo possuí um núcleo central. Os electrões descrevem órbitas circulares em torno do núcleo. Os electrões só podem ocupar determinados níveis de energia. A cada órbita corresponde um valor de energia. Niels Bohr (1885-1962)
- 13. • Identificação de átomos
- 14. QuímicaQuímica Rutherford (1911)Rutherford (1911) Partícula Massa Carga elétrica Próton 1 +1 Nêutron 1 0 Elétron 0 -1 Rutherford não explicou o movimentoRutherford não explicou o movimento dos elétrons ao redor do núcleo.dos elétrons ao redor do núcleo. MODELOS ATÔMICOSMODELOS ATÔMICOS
- 15. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica Número atômico (Z)Número atômico (Z) – é o número de prótons– é o número de prótons existentes no núcleo de um átomo.existentes no núcleo de um átomo. Representa a “identidade do átomo”.Representa a “identidade do átomo”. Exemplo:Exemplo: Z = 1 (Hidrogênio contendo 1 próton)Z = 1 (Hidrogênio contendo 1 próton) Z = 11 (Sódio contendo 11 prótons)Z = 11 (Sódio contendo 11 prótons)
- 16. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica Número de massa (A)Número de massa (A) – é a soma do número– é a soma do número de prótons (Z) e de nêutrons (N) existentes numde prótons (Z) e de nêutrons (N) existentes num átomo.átomo. A = Z + NA = Z + N Observação: os elétrons não são consideradosObservação: os elétrons não são considerados na fórmula, uma vez que a massa dos elétrons éna fórmula, uma vez que a massa dos elétrons é desprezível, se comparada as massas dosdesprezível, se comparada as massas dos prótons e nêutrons.prótons e nêutrons. Exemplo: O átomo de Na tem 11Exemplo: O átomo de Na tem 11 prótons, 12 nêutrons e 11 elétrons.prótons, 12 nêutrons e 11 elétrons. A = 11 + 12 = 23A = 11 + 12 = 23
- 17. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica Elemento químicoElemento químico – é o conjunto de átomos– é o conjunto de átomos com o mesmo número atômico (Z).com o mesmo número atômico (Z). Exemplo:Exemplo: o elemento químico potássio (K), ou seja,o elemento químico potássio (K), ou seja, todos os átomos que apresentam o número atômico 19.todos os átomos que apresentam o número atômico 19. Representação das partículas em um átomo:Representação das partículas em um átomo: 1919KK3939 temos: Z = 19, A = 39 e N = 20temos: Z = 19, A = 39 e N = 20 Observação: vale ressaltar que o númeroObservação: vale ressaltar que o número atômico (Z) é a “identidade” do átomo, é aatômico (Z) é a “identidade” do átomo, é a partir dele que caracterizamos opartir dele que caracterizamos o elemento.elemento.
- 18. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica Isótopos, isóbaros e isótonosIsótopos, isóbaros e isótonos Com base no número atômico (Z), númeroCom base no número atômico (Z), número de massa (A) e número de nêutrons (N) dede massa (A) e número de nêutrons (N) de diferentes átomos, podemos encontrardiferentes átomos, podemos encontrar conjuntos de átomos que apresentam algumconjuntos de átomos que apresentam algum número em comum. Para tanto, surgiramnúmero em comum. Para tanto, surgiram alguns conceitos que definem estasalguns conceitos que definem estas igualdades:igualdades:
- 19. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica IsótonosIsótonos -- são átomos com mesmo númerosão átomos com mesmo número de nêutrons que apresentam diferentesde nêutrons que apresentam diferentes números de massa e números atômicosnúmeros de massa e números atômicos (elementos diferentes).(elementos diferentes). Exemplo:Exemplo: 1717ClCl3737 2020CaCa4040 ambos apresentam N = 20ambos apresentam N = 20
- 20. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica IsóbarosIsóbaros - são átomos com mesmo número- são átomos com mesmo número de massa (A) e diferentes números de prótonsde massa (A) e diferentes números de prótons (elementos diferentes).(elementos diferentes). Exemplo:Exemplo: 1919KK4040 2020CaCa4040 ambos apresentam A = 40ambos apresentam A = 40
- 21. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica IsótoposIsótopos são átomos com mesmo número desão átomos com mesmo número de prótons (Z) e diferente número de massa (A).prótons (Z) e diferente número de massa (A). Portanto, isótopos são átomos do mesmoPortanto, isótopos são átomos do mesmo elemento químico que apresentam diferenteselemento químico que apresentam diferentes números de nêutrons.números de nêutrons. Exemplo:Exemplo: 66CC1212 66CC1414 ambos apresentam Z = 6ambos apresentam Z = 6
- 22. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica ÍonsÍons – são átomos que ganharam ou– são átomos que ganharam ou perderam elétrons.perderam elétrons. CátionCátion – quando um átomo perde elétron(s), ele se– quando um átomo perde elétron(s), ele se torna um íon positivo.torna um íon positivo. Exemplo:Exemplo: Na (sódio) no estado normal apresenta 11Na (sódio) no estado normal apresenta 11 prótons, 12 nêutrons eprótons, 12 nêutrons e 11 elétrons11 elétrons.. NaNa1+1+ (cátion sódio) com a perda de 1 elétron(cátion sódio) com a perda de 1 elétron passa a apresentar 11 prótons, 12 nêutrons epassa a apresentar 11 prótons, 12 nêutrons e 1010 elétronselétrons..
- 23. IDENTIFICAÇÃO DOS ÁTOMOSIDENTIFICAÇÃO DOS ÁTOMOS QuímicaQuímica ÂniosÂnios – quando um átomo ganha elétron(s), ele se torna– quando um átomo ganha elétron(s), ele se torna um íon negativo.um íon negativo. Exemplo:Exemplo: Cl (cloro) no estado normal apresenta 17 prótons,Cl (cloro) no estado normal apresenta 17 prótons, 18 nêutrons e18 nêutrons e 17 elétrons17 elétrons.. ClCl1-1- (ânion cloreto) com o ganho de 1 elétron(ânion cloreto) com o ganho de 1 elétron passa a apresentar 17 prótons, 18 nêutrons epassa a apresentar 17 prótons, 18 nêutrons e 1818 elétronselétrons..