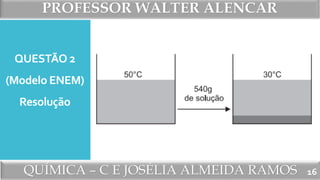
O documento apresenta exercícios de química sobre solubilidade, incluindo questões, resoluções e textos explicativos. A primeira questão trata do cálculo do coeficiente de solubilidade de um sal a partir da massa de resíduo obtido após evaporar uma solução saturada. A segunda questão, modelo do ENEM, calcula a massa de cristais que se separam de uma solução saturada de sacarose ao ser resfriada. As questões subsequentes abordam conceitos como solubilidade, curvas de solubilidade e classificação de soluções