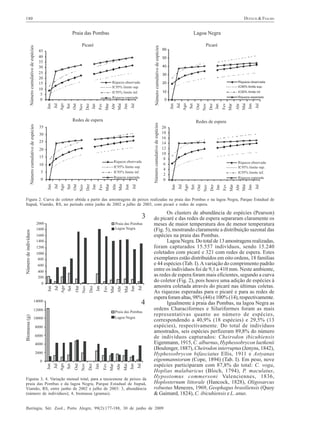
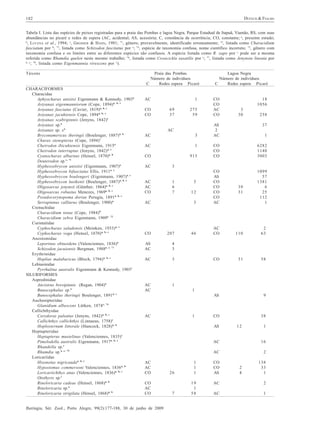
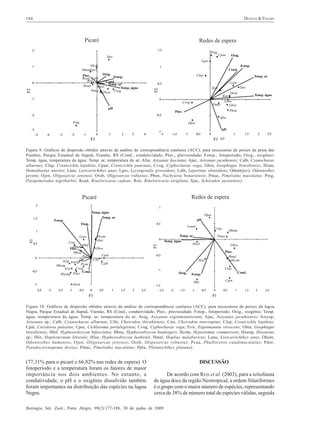
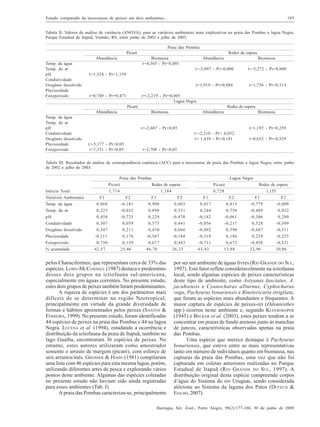
Este estudo compara as comunidades de peixes (taxocenoses) em dois ambientes aquáticos no Parque Estadual de Itapuã, sul do Brasil: a Praia das Pombas e a Lagoa Negra. Foram amostradas 61 espécies de peixes no total, sendo 44 espécies em cada local. As taxocenoses variaram espacial e temporalmente, com maior abundância, biomassa e diversidade nos meses quentes de primavera e verão. A temperatura e duração do dia foram os principais fatores que influenciaram a