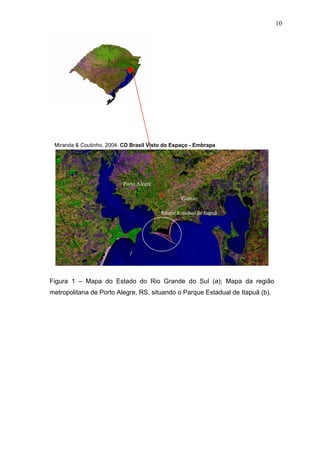
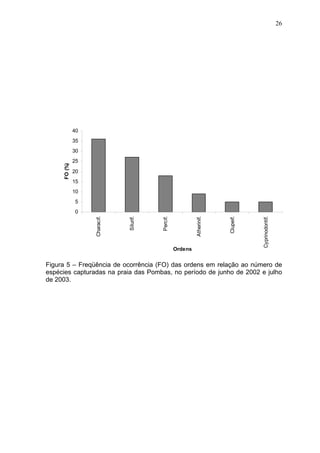
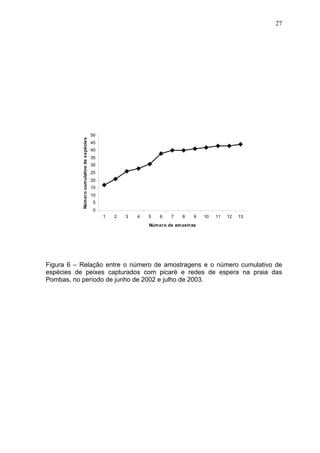
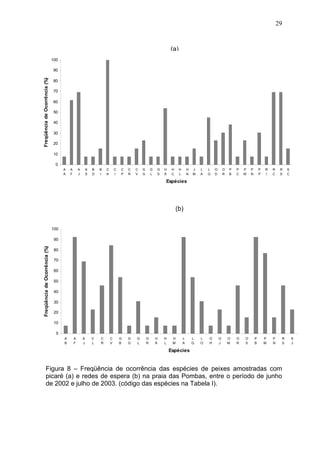
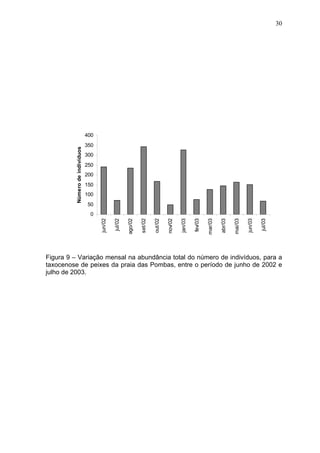
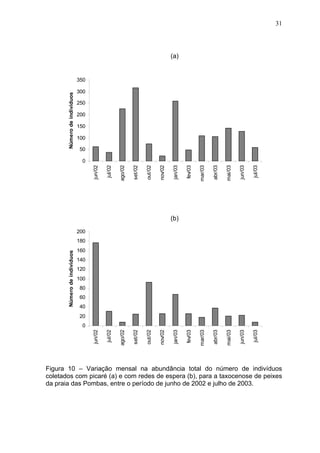
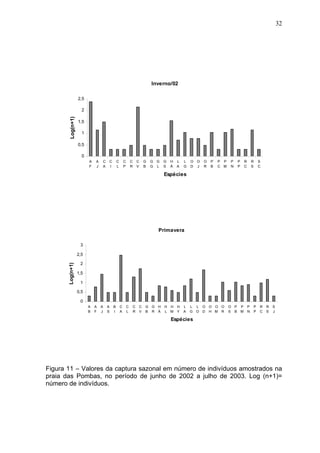
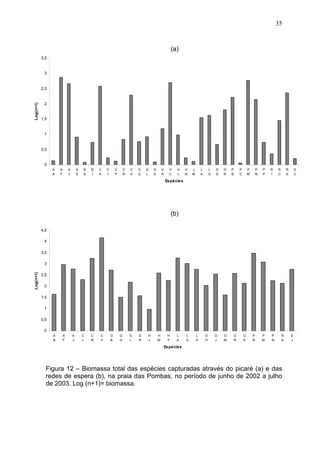
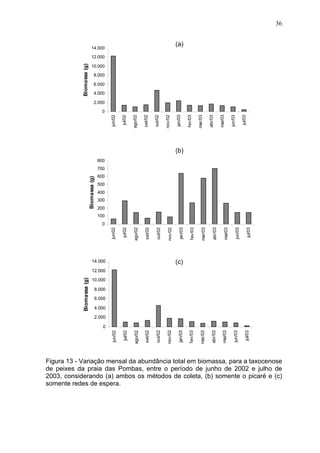
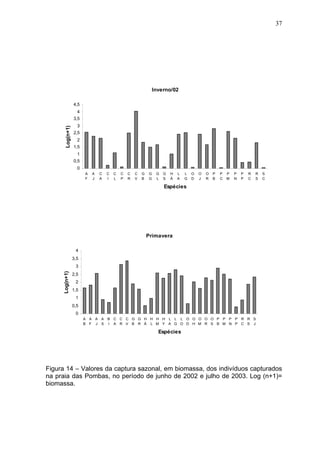
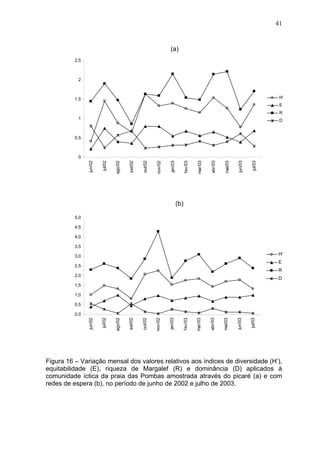
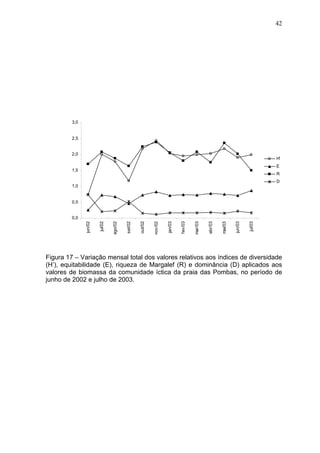
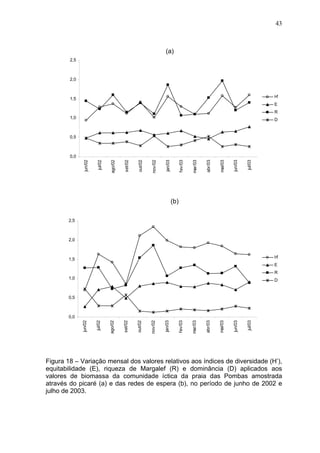
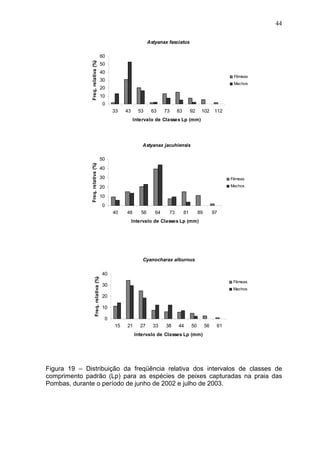
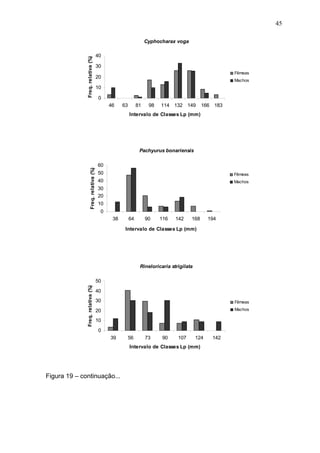
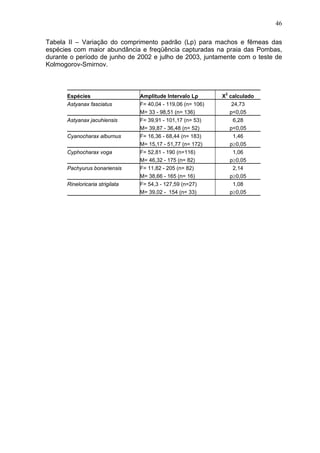
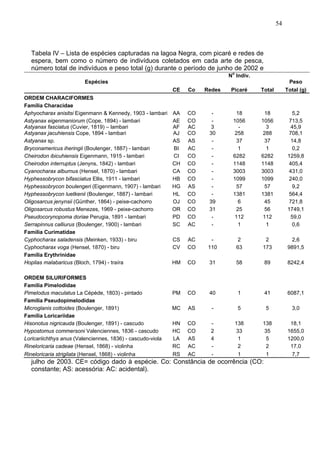
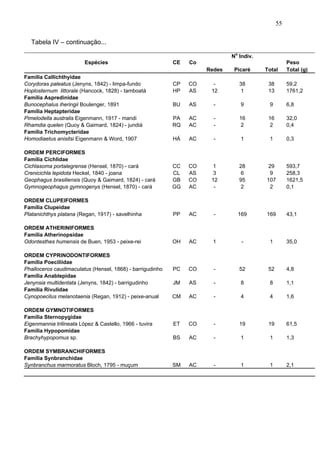
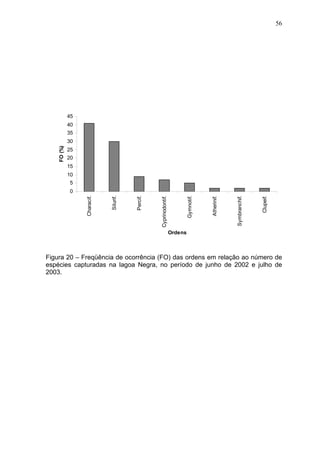
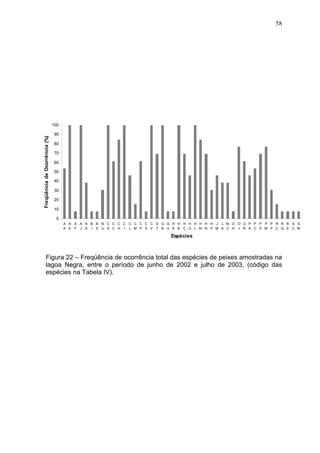
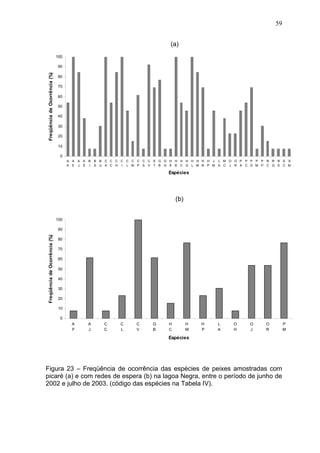
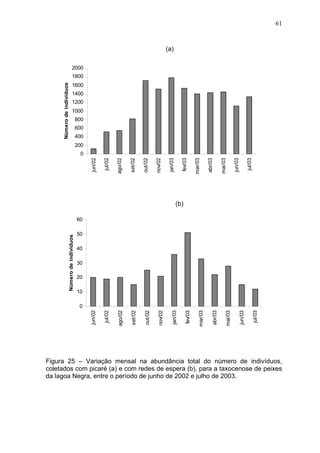
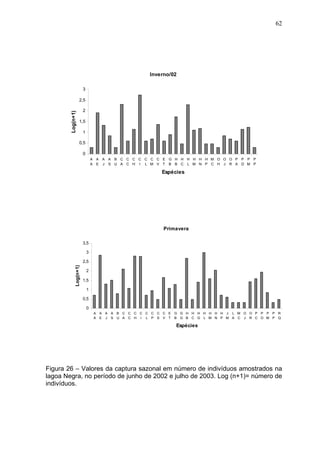
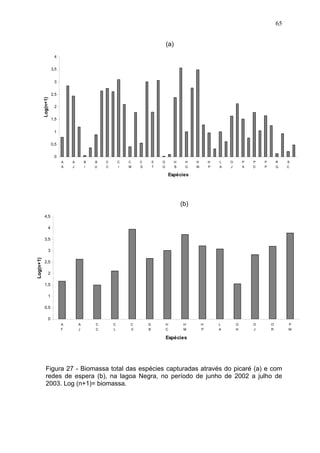
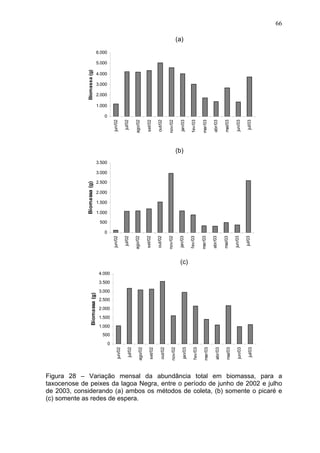
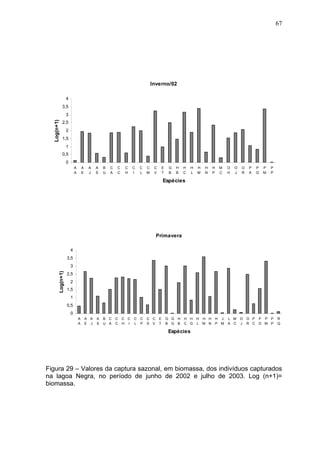
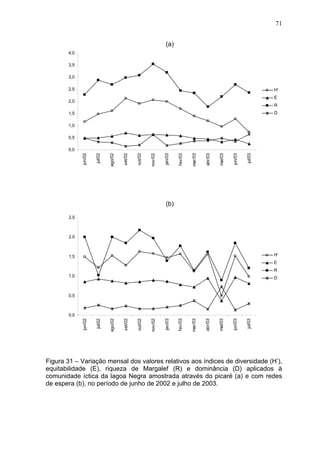
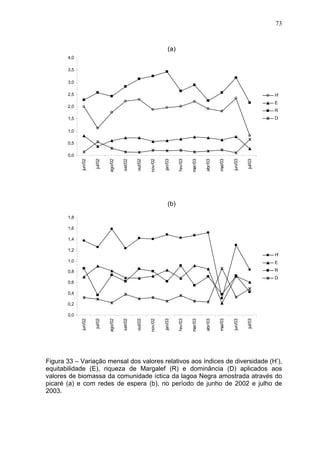
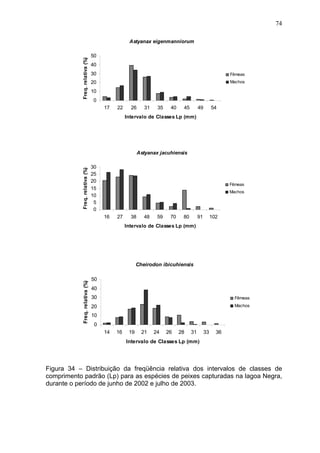
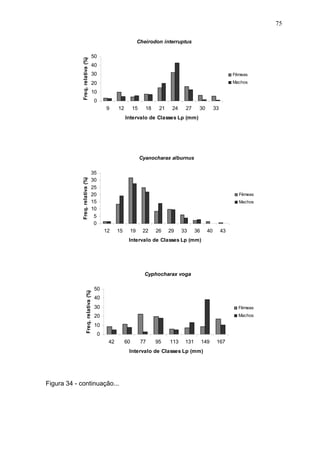
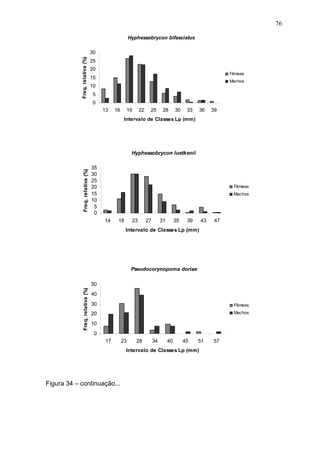
Este estudo caracterizou e comparou a ictiofauna da praia das Pombas e da lagoa Negra no Parque Estadual de Itapuã, focando em composição, ocorrência, abundância e diversidade de espécies em relação a fatores ambientais. Coletas mensais entre junho de 2002 e julho de 2003 resultaram na captura de 2160 indivíduos de 44 espécies na praia das Pombas, com destaque para Astyanax fasciatus e Cyanocharax alburnus. A lagoa Negra, em contraste, apresenta águas escuras e ácidas, com abundância de macrófitas aquáticas.