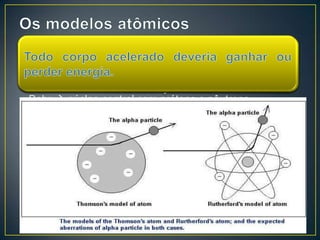
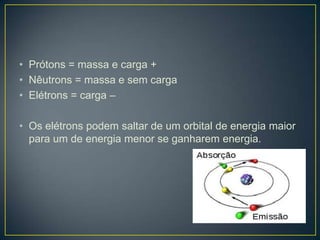
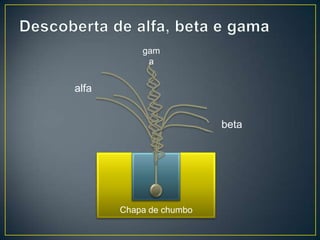
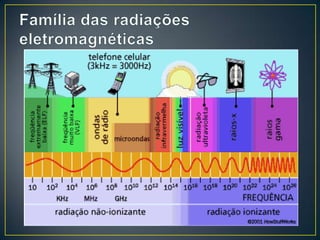
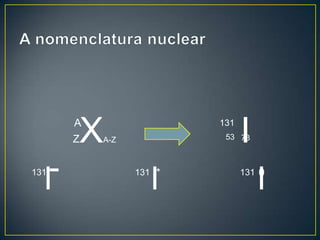
O documento discute os conceitos fundamentais da radioatividade e da física nuclear, incluindo os tipos de radiação, modelos atômicos, tabela periódica, descoberta das radiações, nomenclatura nuclear, desintegração radioativa, interação das radiações com a matéria, detectores de radiação e produção de radionuclídeos. Também apresenta os principais descobridores no campo como Becquerel, Curie, Thomson, Rutherford, Chadwick e Einstein.