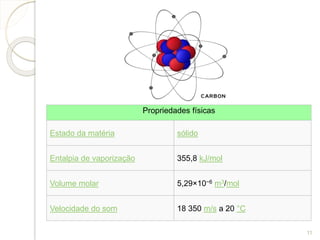
O documento resume as propriedades e usos do níquel e do carbono. O níquel é um metal branco prateado encontrado naturalmente em meteoritos. Pode ser usado em ligas metálicas e baterias. O carbono existe em diversas formas, como grafite e diamante, e é essencial para a vida. É usado em combustíveis, plásticos e fibra de carbono.