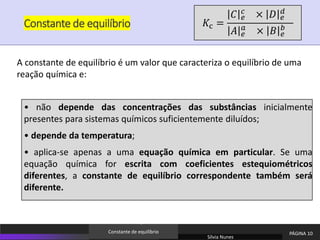
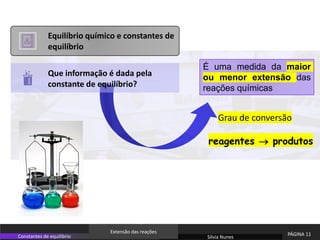
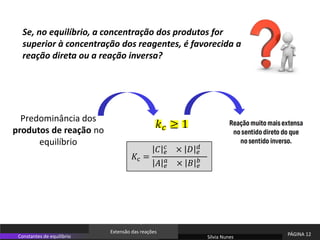
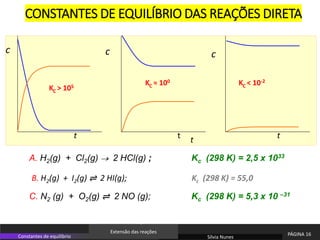
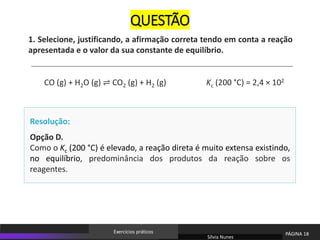
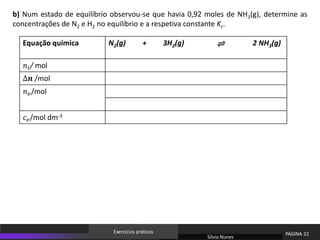
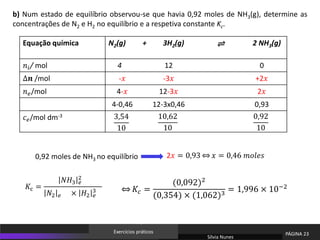
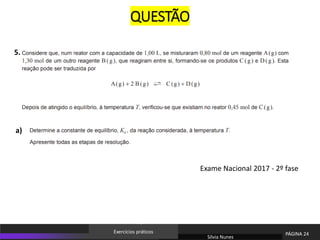
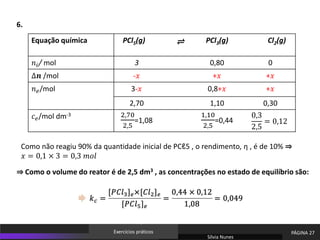
O documento discute equilíbrio químico e constantes de equilíbrio. Explica que a constante de equilíbrio é uma medida da extensão relativa das reações direta e inversa e depende apenas da temperatura. Quanto maior for a constante de equilíbrio, mais extensa é a reação direta em relação à inversa.


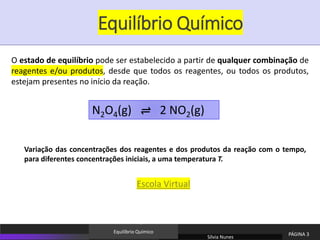
![Equilíbrio Químico
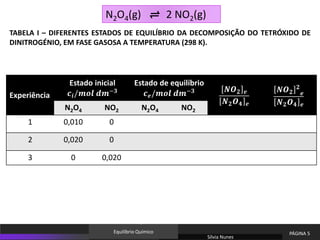
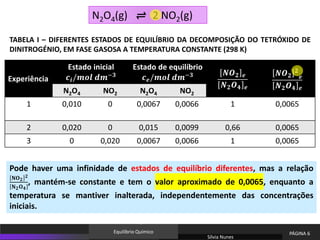
N2O4(g) ⇌ 2 NO2(g)
Variação das concentrações dos reagentes e dos produtos da reação para diferentes
concentrações iniciais, a uma temperatura T (298 K).
A composição do estado de equilíbrio atingido depende das condições iniciais do
sistema.
Sílvia Nunes
PÁGINA 4
Equilíbrio Químico
[N2O4] =0,020 mol dm-3
[N2O4] =0,010 mol dm-3 [NO2] =0,020 mol dm-3](https://image.slidesharecdn.com/extensodereaes-230905091538-bfe56d6f/85/Extensao-de-reacoes-pdf-4-320.jpg)