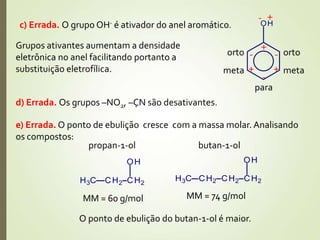
O documento discute os processos mecânicos de purificação do petróleo bruto antes do refino, que são a decantação para separar o petróleo da água salgada e a filtração para separar impurezas sólidas como areia e argila. Também aborda questões sobre configuração eletrônica do alumínio e produção de cerâmica.

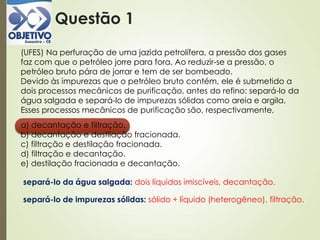


![Questão 3
O artesanato em cerâmica é característico de alguns municípios de
nosso Estado. O processo de produção das peças de barro envolve
misturar determinada quantidade de argila com água, resultando em
uma massa, que depois é aquecida. Os elementos mais freqüentes
nessas argilas são silício, oxigênio, alumínio, ferro, magnésio, potássio e
sódio. Com base nessas informações, é correto afirmar:
a) o silício é o mais eletronegativo e possui configuração eletrônica
[Ne] 3 s2 3 p3.
b) Todos os elementos têm o nível 2 totalmente ocupado.
c) o processo de produção da cerâmica necessita de altas
temperaturas, porque os elementos envolvidos demoram a
combinar-se devido as suas propriedades metálicas.
d) o alumínio possui 3 elétrons na camada de valência.](https://image.slidesharecdn.com/aula20-05-alcidenio-140519124834-phpapp01/85/Aula-20-05-alcidenio-5-320.jpg)
![14Si
8O
13Al
26Fe
12Mg
19K
11Na
Eletronegatividade
1s2 2s2 2p6 3s2 3p2
[Ne] 3s2 3p2
a) Errada
1s2 2s2 2p4
b) Errada
c) Errada
1s2 2s2 2p6 3s2 3p1
d) Correta](https://image.slidesharecdn.com/aula20-05-alcidenio-140519124834-phpapp01/85/Aula-20-05-alcidenio-6-320.jpg)






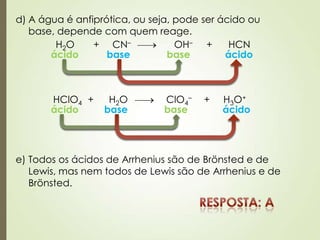
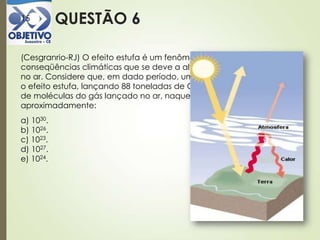


![Questão 818
(UEL-PR) Considere as seguintes entalpias de formação em kj/mol:
Al2O3(s) = – 1670; MgO(s) = – 604.
Com essas informações, pode-se calcular a variação da entalpia da
reação representada por:
3 MgO (s) + 2 Al (s) 3 Mg (s) + Al2O3 (s)
Seu valor é igual a:
a) – 1066 kj.
b) – 142 kj.
c) + 142 kj.
d) + 1066 kj.
e) + 2274 kj.
H = Hfinal – Hinicial
H = [1 x (– 1670)] – [3 x (– 604)]
(– 1812)H = (–1670) –
1812H = – 1670 +
H = + 142 kj](https://image.slidesharecdn.com/aula20-05-alcidenio-140519124834-phpapp01/85/Aula-20-05-alcidenio-18-320.jpg)





![m1 = 0,365 g HCl
M = ?
V = 1000 L
HCl
H: 1,0 g
Cl: 35,5 g
36,5 g/mol
100 M = 0,01 mol/L
ou 10-2 mol/L
[H+] = M ·
Ácido forte: = 100%
[H+] = 10-2 · 1
[H+] = 10-2 mol/L
pH = - log [H+]
pH = - log 10-2
pH = 2
I. É mais ácida que uma solução de pOH = 13.
pH + pOH = 14 pH = 14 – 13 pH = 1
II. O seu pH é 2.
III. A sua concentração hidroxiliônica é igual a 10-12 mol/L
pH + pOH = 14 pOH = 14 – 2 pOH = 12
[OH-] = 10-12 mol/L
VMM
m
M
1
1
L1
mol
g
36,5
g0,635
M
L100
mol1
M](https://image.slidesharecdn.com/aula20-05-alcidenio-140519124834-phpapp01/85/Aula-20-05-alcidenio-25-320.jpg)





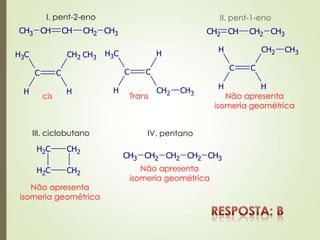

![a) Errada. A adição de HBr ao propeno ocorre segundo a regra de
Markovnikov (o eletrófilo se adiciona preferencialmente ao carbono mais
hidrogenado da dupla).
carbono mais hidrogenado
+ HBr
H+
Br-
b) Correta. Álcoois primários oxidam produzindo aldeídos que podem
oxidar produzindo ácidos carboxílicos, álcoois secundários oxidam
produzindo cetonas e ácoois terciários não oxidam.
[O] [O]
[O]](https://image.slidesharecdn.com/aula20-05-alcidenio-140519124834-phpapp01/85/Aula-20-05-alcidenio-34-320.jpg)