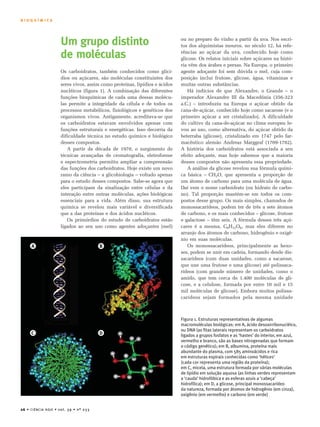
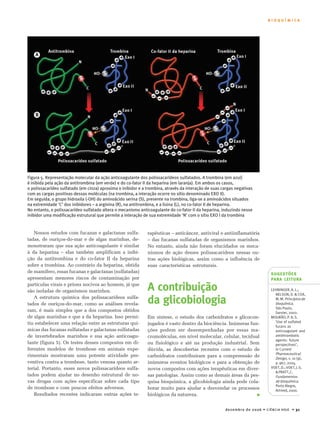
O documento discute carboidratos, substâncias abundantes na natureza com funções variadas no organismo. Carboidratos incluem açúcares simples como glicose e frutose, e polímeros como amido e celulose. Estudos recentes revelaram que carboidratos desempenham papéis importantes além de armazenamento de energia, como reconhecimento e sinalização celular. Alguns carboidratos marinhos podem ser candidatos para substituir a heparina.