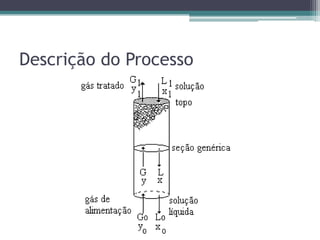
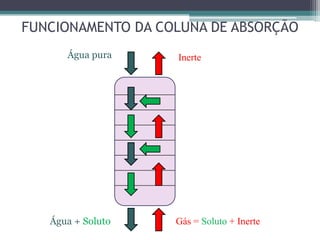
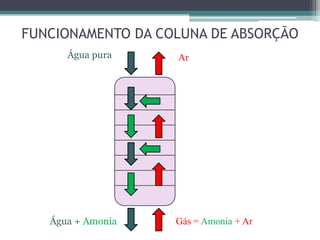
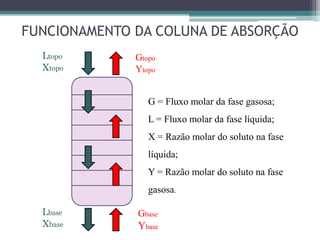
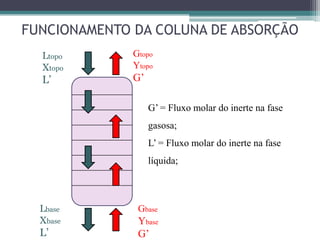
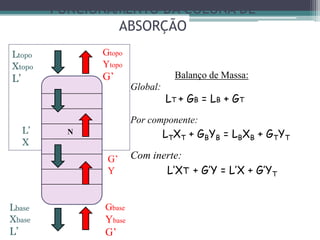
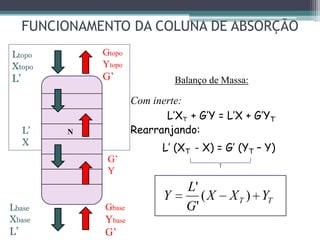
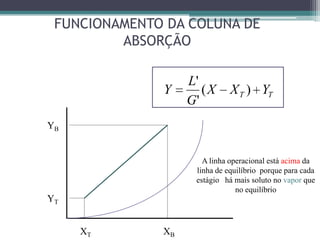
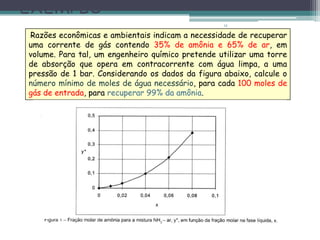
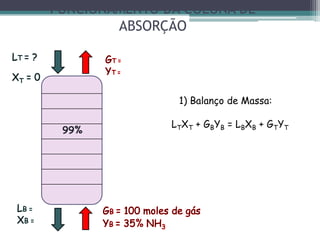
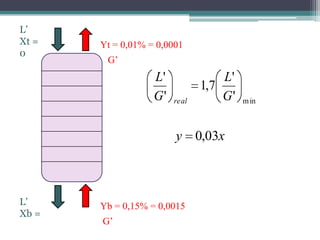
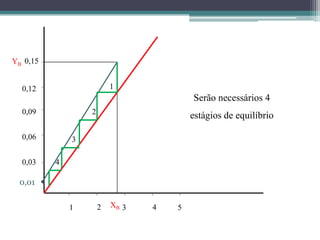
O documento descreve o processo de absorção gasosa, no qual um componente solúvel é transferido da fase gasosa para uma fase líquida absorvente. Apresenta as aplicações do processo com e sem reação química e descreve o funcionamento de uma coluna de absorção em contracorrente, incluindo balanços de massa.