1. O documento discute o tratamento de efluentes contendo cianeto, substância tóxica usada no processo de extração de ouro por cianetação.
2. São descritos vários métodos para tratar efluentes contendo cianeto, incluindo métodos físicos, de adsorção, complexação e oxidação.
3. Os principais métodos são diluição, separação com membranas, eletro-recuperação, hidrólise e destilação, acidificação/volatilização/recuperação, adição de meta
![Tratamento de efluentes
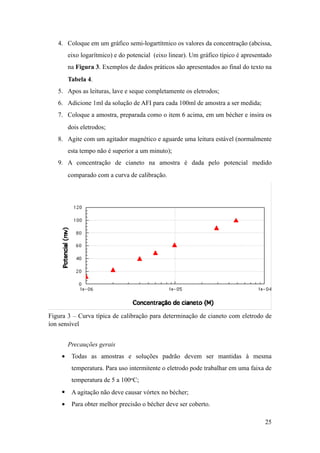
contendo cianeto
Roberto de Barros Emery-Trindade
1 – Introdução
A produção industrial de ouro em todo o mundo utiliza principalmente o processo
conhecido como cianetação, conforme já visto em outros capítulos. Este processo é
conhecido desde o final do século XIX, quando em 1887 uma patente britânica foi
concedida a John Steward MacArthur. Para o desenvolvimento daquele trabalho,
MacArthur contou com a assistência e o apoio dos irmãos Robert e William Forrest
(ambos médicos), os quais foram os que de fato fizeram a descoberta em um
consultório médico em Glasgow, Escócia [Habashi, 1987; Trindade, 1992]. A patente,
denominada “Processo de obtenção de ouro e prata de minérios” rapidamente tornou-
se conhecida como o “Processo de Cianetação”, em razão de seu sucesso industrial.
Com a implantação desse processo, a produção de ouro cresceu mais de quatro vezes
entre 1901 e 1950, comparada com o período de 1851 a 1900. A produção acumulada
total de ouro em todo o mundo é estimada em mais de 1700 t. O maior produtor é a
África do Sul, onde mais de 300 mil pessoas estão diretamente envolvidas na extração
e produção de ouro. Alem disso, cerca de 40% das reservas conhecidas encontram-se
na África do Sul. O Brasil detém entre 25-30% das reservas mundiais conhecidas.
As principais vantagens de usar o cianeto na lixiviação de ouro podem ser
apontadas como as seguintes:
• o cianeto é seletivo na dissolução de ouro
• a prata também pode ser recuperada;
• pode ser considerado um processo simples que incorpora uma grande
experiência industrial e tecnológica, sobretudo se comparado a processo que
!1](https://image.slidesharecdn.com/tratefluentescn-170711025247/75/Tratamento-de-efluentes-contendo-ion-cianeto-1-2048.jpg)







![inferior, portanto, ao da água (100 ˚C). Dessa forma, a separação do cianeto pode ser
efetivada em temperaturas não muito elevadas e/ou à pressão reduzida. O gás
cianídrico pode ser capturado e concentrado para reciclagem em torres de absorção. A
vaporização para a atmosfera também pode ocorrer naturalmente em bacias de rejeito,
especialmente nas temperaturas mais altas do verão. Os dissociáveis em meio ácido
forte ou fraco não são afetados pro esse processo.
Métodos com complexação
Acidificação / volatilização / recuperação
Como já visto, em valores de pH inferiores a cerca de 9 começa a ocorrer a
formação do HCN (g); o cianeto tem predominânica até valores de pH de cerca de 11,
o que explica o fato de as operações de metalurgia extrativa do ouro serem realizadas
nessa faixa de pH. Por outro lado, o cianeto irá volatilizar-se em valores de pH
inferiores a cerca de 8, aumentando a taxa dessa volatilização com a diminuição do
pH. Caso o valor de pH seja inferior a 2, o gás cianídrico também será produzido a
partir dos WAD:
M(CN)x
y-x + xH+ = xHCN(g) + My+ (10)
O processo de acidificação e volatilização ocorre tipicamente em valores de pH entre
1 e 2. Após a acidificação, a solução está predominantemente isenta de cianeto mas
deve ser re-neutralizada de forma a permitir sua reciclagem. A re-neutralização
provoca a precipitação de metais liberados pela reação indicada acima. Caso seja
utilizado calcário [Ca(OH)2] e ácido sulfúrico (H2SO4) para neutralização e
acidificação, respectivamente, haverá a precipitação de gipsita (CaSO4.xH2O). A
presença de outros metais concorrerá para a formação de uma lama difícil de separar e
de desidratar. Esse problema pode ser contornado, ou minimizado, com o emprego de
outras bases, como NaOH, e ácidos como o HNO3. Estes reagentes, contudo, são mais
!10](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-10-320.jpg)

![Fe(CN)6
4- + 4Fe3+ = Fe4[Fe(CN)6]3 (s) (12)
Essa metodologia, entretanto, tem recebido pouca aplicação atualmente.
Flotação
Empregada pela primeira vez em 1808, a flotação pode ser utilizada para separar os
complexos e /ou precipitados formados naturalmente ou durante a adição de metais. O
processo deve ser conduzido rapidamente para evitar a redissolução das espécies que
se quer eliminar. No caso da flotação iônica, uma amina como o tricaprilmetil cloreto
de amônia (R4NCl) é adicionado para reagir com o complexo aniônico e precipitar o
como um sal orgânico (R):
(y-x)R4NCl + M(CN)x
y-x = (R4N)y-xM(CN)6(s) + (y-x)Cl- (13)
Para o caso da prévia adição de FeSO4, o produto básico formado é o Fe4[Fe(CN6)]3.
Outros reagentes podem ser utilizados, e ainda há ainda muita margem para
aperfeiçoamento e otimização do processo.
Métodos por adsorção
Vários minerais, resinas e o carvão ativado são capazes de adsorver o cianeto
contido em solução. Uma vez adsorvido, o material que adsorveu o cianeto é
separados da solução por filtragem, flotação ou separação gravimétrica. É então
colocado em outro recipiente onde o cianeto pode ser dessorvido utilizando-se
pequeno volume de uma solução podendo ser, dessa forma, concentrado. O material
de adsorção pode ser então novamente separado e reativado para ser reutilizado.
Exemplos de minerais empregados para essa adsorção: ilmenita (FeTiO3), bauxita
[AlO.OH. Al(OH)3], feldspatos, zeólitas e argilas.
O carvão ativado é preparado por meio de uma decomposição termoquímica
parcial do material carbonoso, seja madeira, carvão mineral, casca de côco, entre
!12](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-12-320.jpg)


![Eletrólise
Os princípios da eletro-recuperação podem ser aplicados na remediação de soluções
contendo cianeto. Uma característica importante é que o interesse é oxidar o
complexo metal –cianeto e não reduzir como é o caso da eletro-recuperação. Note-se
ainda que o cianeto e o anodo tem cargas opostas, concorrendo para uma melhor
eficiência de corrente. O radical cianato pode ser produzido por eletro-oxidação ou
eletro-cloração. Na primeiro caso a reação é
CN- + 2 OH- = CNO- + H2O + 2e- (17)
Na eletro-cloração a reação global é a mesma, porém ocorre em outras etapas (Botz,
M.M., 2001; Arikado et al., 1976)
2Cl- = Cl2(g) + 2e- [18]
CN- + Cl2(g) = CNCl(aq) + Cl- [19]
CNCl(aq) + 2OH- = CNO- + H2O + Cl- [20]
O gás cloro cianogênio (CNCl), ou gás lacrimogêneo, é formado pela regeneração dos
íons cloreto, atuando portanto como um catalisador. A reação é normalmente
conduzida a uma temperatura entre 40 e 50˚C.
Notar que, embora ambos os processos sejam capazes de oxidar o cianeto, não
conseguem oxidar os complexos fortes, os quais permanecem estáveis em solução.
Adição química de agentes oxidantes
A forma mais amplamente adotada para destruição de cianeto é pela adição de agentes
oxidantes. Os mais comuns são oxigênio, ozônio, peróxido de hidrogênio, cloro,
hipoclorito de sódio, este como agente único ou associado a peróxido de hidrogênio.
!15](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-15-320.jpg)

![de aumentar a cinética da reação do cianeto com peróxido de hidrogênio. Alguns
desses reagentes são íons cúprico, formaldeído, ácido sulfúrico e hipoclorito de sódio.
O íon cúprico pode agir como um catalisador para as reações acima (Marsden e
House, 1992)]. O uso do formaldeído é patenteado pela Du Pont e os produtos finais
incluem cianato e amônia. Quando ácido sulfúrico e peróxido de hidrogênio são
misturados, uma reação altamente exotérmica ocorre, com a formação de ácido
persulfúrico ou ácido de Caro, H2SO5 (Teixeira, L.A., 2002). Este reage com o cianeto
para produzir cianato:
CN- + H2SO5(aq) = CNO- + H2SO4(aq) (28)
Os complexos fortes não são atacados e não há evolução do gás hidrociânico, apesar
da adição de um ácido. Isso é explicado pela alta cinética de reação e pelo fato de os
complexos fortes não volatilizarem já que o equilíbrio se estabelece entre valores de
pH de 6-8.
A cloração tem sido utilizada desde os primórdios do processo de cianetação, por
volta de 1890. A cloração remove os complexos fracos e o cianeto livre, mas não os
complexos fortes. Além disso, o processo tem um elevado consumo de reagentes em
razão do controle de pH e consumo de gás cloro. A reação básica de oxidação é:
CN- + Cl2(g) + 2OH- = CNO- + H2O + Cl- (29)
O tiocianto também reage com o cloro, assim como os complexos metal - cianeto:
SCN- + 4Cl2(g) + 10OH- = CNO- + SO4
2- + 8Cl- + 5H2O (30)
M(CN)x
y-x + xCl2(g) + (2x+y)OH- = XCNO- + 2xCl- + M(OH)y + xH2O (31)
Os óxidos e sulfetos precipitam em razão do elevado valor de pH. Entretanto, apenas
os complexos metálicos fracos reagem conforme a reação 31. Quando adicionado em
!18](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-18-320.jpg)

![Cloração alcalina
(químico)
Oxidação a CNO-
com Cl2 ou ClO-
em pH > 11
Cl2 / ClO-, NaOH CNO-, CO3
2-
SO2 / ar – processo
INCO (químico)
Oxidação a CNO-
com SO2/ar e Cu2+
como catalisador
SO2, ar e Cu2+
catalisador CNO-
Peróxido de
hidrogênio (H2O2)
– processo
Degussa (químico)
Oxidação a CNO-
com H2O2 e Cu2+
H2O2 CNO-, CO3
2-, NH4
+
Ácido de caro
(químico)
Oxidação a CNO-
com H2SO5
H2SO5 CNO-
Carvão ativado
(químico; físico)
Oxidação a CNO- e
parcialmente a
CO3
2-, NH4
+ com
carvão ativado e
Cu2+ como
catalisador
Carvão ativado, ar,
O2 e Cu2+
catalisador
CNO-, CO3
2-, NH4
+
Biodegradação
(biológico)
Oxidação a CO3
2-,
NH4
+ e NO3-
usando bactérias
locais
Na2CO3, H3PO4
CNO-, CO3
2-,
NH4
+, SO4
2-
Ozônio (químico)
Oxidação a CO3
2- e
N2
O3 CO3
2-, N2
Degradação natural
(biológico,
químico, físico)
Volatilização do
HCN nas barragens
de rejeito
--
HCN
principalmente
AVR (químico e
físico)
Acidificação-
Volatilização-
Reneutralização.
Após acidificar a
pH<8, HCN evolui
e ‘absorvido por
solução de NaOH.
Metais precipitam.
H2SO4, NaOH
HCN,
possivelmente
SCN-
Precipitação com
ferro (azul da
Prússia-químico)
Precipitação de
Fe4[Fe(CN)6]3 pela
adição de FeSO4
FeSO4 Fe4[Fe(CN)6]3
!20](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-20-320.jpg)
![Osmose reversa
(físico)
Remoção física do
cianeto e
complexos com
uma membrana
semipermeável em
processo sob
pressão
-- CN-
Flotação (físico-
químico)
Adsorção de
partículas de CN
precipitadas sobre
pequenas bolhas de
ar
FeSO4, surfatante Fe4[Fe(CN)6]3
!21](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-21-320.jpg)
![APÊNDICE
Determinação de Cianeto com eletrodo seletivo de íon
A análise de cianeto com um eletrodo de íon seletivo é um método rápido e
preciso para determinação de cianeto livre. A seguir são apresentadas instruções
básicas para a aplicação dessa técnica com sucesso.
Princípios da operação
A determinação é baseada no comportamento da parte sensível do eletrodo de
cianeto. Essa parte encontra-se na ponta inferior do eletrodo e consiste em uma
membrana contendo um haleto de prata, misturado a um material de suporte
apropriado, que pode ser silicone, borracha ou uma mistura de sais inorgânicos.
Quando esta membrana entra em contato com a solução de cianeto, os íons de prata
contidos na superfície da membrana dissolvem formando um complexo de acordo
com:
AgX +2CN- = Ag(CN)2
- +X-
Como conseqüência, os íons de prata contidos na membrana irão mover para
preencher o espaço daqueles que foram complexados. Isto determinará a diferença de
potencial que corresponde à concentração de cianeto na solução. O potencial é então
medido contra um eletrodo padrão e é determinado pela equação de Nernst:
E= Eo-S.log[CN]-
onde E é a leitura do potencial
Eo é o potencial do eletrodo padrão
S é declividade da equação
[CN]- é a concentração de íons cianeto na solução
!22](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-22-320.jpg)
![Rigorosamente, o termo de [CN] – deveria ser substituído pela atividade do
cianeto, a qual relaciona-se com a concentração de cianeto pelo coeficiente de
atividade γ. Este coeficiente é variável e depende da força iônica da solução.
Entretanto, se a força iônica é muito alta e constante com relação à concentração do
íon que está sendo medido, γ pode ser considerado constante e portanto a atividade
torna-se diretamente proporcional à concentração. Por esta razão, uma solução de
ajuste da força iônica (AFI) é sempre adicionada tanto à solução padrão quanto à
amostra contendo cianeto. Nestas condições, a força iônica permanece alta e constante
com relação ao cianeto. Para o caso dos eletrodos sensíveis ao cianeto, a solução AFI
recomendada é de 10 M NaOH.
Reagentes
A determinação do cianeto é realizada com o auxílio de uma curva de
calibração. Para construir esta curva alguns reagentes devem ser preparados:
A. Pelo menos 100ml da solução AFI. Essa é uma solução muito corrosiva e deve
ser manuseada com extremo cuidado. É também recomendado que esta
solução seja mantida em um frasco de plástico.
B. Uma solução padrão 10-2 molar de cianeto preparada no mínimo
semanalmente (0,65g de KCN em 1L de água destilada). Adicione 1ml da
solução AFI para cada 100ml de solução padrão.
C. 00ml de uma solução 10-3 molar de cianeto, a qual é preparada pela diluição
da solução padrão acima. Adicione 1ml para cada 100ml preparado. Esta
solução deve ser preparada diariamente.
Aparelhagem e faixa de determinação
Qualquer potenciômetro capaz de fazer leituras de potencial e pH pode ser
utilizado. No presente caso um modelo 654 da METROHN foi utilizado para todas as
leituras. O eletrodo seletivo foi o modelo 94-4096 da RUSSELL e um eletrodo de
calomelano tipo CRL/DJ/NaNO3 da RUSSELL foi utilizado como eletrodo de
!23](https://image.slidesharecdn.com/tratefluentescn-170711025247/85/Tratamento-de-efluentes-contendo-ion-cianeto-23-320.jpg)