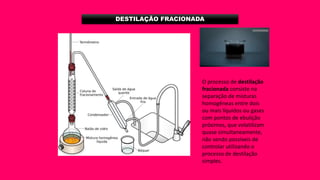
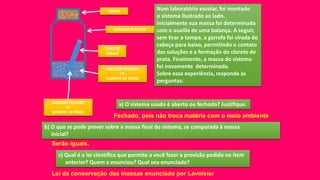
O documento discute vários métodos de separação de misturas, incluindo evaporação, cristalização, destilação, decantação, centrifugação, filtração, sublimação e flotação. Ele explica quando cada um desses processos deve ser usado dependendo do tipo de mistura a ser separada.