O documento descreve o planejamento de amostragem de água, incluindo a definição de atividades de coleta e transporte de amostras para análise. Detalha os pontos de coleta, equipamentos, métodos e procedimentos de coleta, armazenamento e transporte de amostras para garantir resultados precisos.







































































































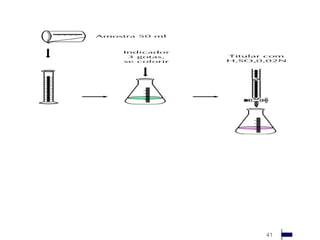
![Dureza Total
Dureza da água é a propriedade relacionada com a
concentração de íons de determinados minerais
dissolvidos nesta substância.
A dureza da água é predominantemente causada pela
presença de sais de Cálcio e Magnésio, de modo que
os principais íons levados em consideração na
medição são os de Cálcio (Ca2+) e Magnésio (Mg2+)
[1].](https://image.slidesharecdn.com/analisedeagua-121005094129-phpapp02/85/Analise-de-agua-110-320.jpg)