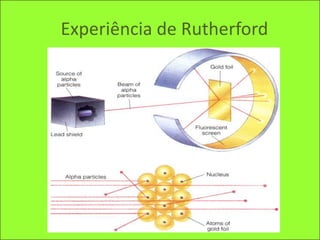
Representação da nuvem eletrónica e distribuição eletrónica dos elementos
- 2. Representação simbólica da nuvem electrónica! Maior probabilidade de encontrar o electrão Zona Mais Densa Menor probabilidade de encontrar o electrão Zona Menos Densa Identificação de átomos Z = Número atómico = número de protões do núcleo N = Número de neutrões do núcleo A = Número de massa = nº de protões + nº de neutrões
- 3. Porquê esta fórmula? Elemento Químico: conjunto de átomos que possui o mesmo número atómico!
- 4. Isótopos Será que os átomos de um determinado elemento químico são todos iguais? Ou será que existem excepções? São átomos do mesmo elemento químico, com o mesmo número atómico (Z) mas com número de massa diferente (A) Têm diferentes números de neutrões!
- 5. Iões A carga do núcleo mantém-se inalterada quando o átomo origina o ião (catião ou anião). O átomo e o respectivo ião mantêm o mesmo número atómico e o mesmo número de massa – diferem apenas o número de electrões!
- 6. Modelo de Rutherford-Bohr Energia Aumenta O número máximo de electrões no último nível de energia ou camada (à excepção do 1º nível, camada K), é 8! Tarefa: Escreve as distribuições electrónicas dos elementos químicos com Z = 1 até Z = 20
- 7. Notação de Lewis Representa-se o número de electrões de valência por pontos (ou cruzes) à volta do símbolo químico do elemento! Átomos do elementos do mesmo grupo têm mesmo número de electrões de valência! Há uma ordem de preenchimento dos níveis de energia: níveis de energia mais baixa! Átomos do elementos do mesmo período têm o mesmo número de níveis!
- 8. Grupo 1 – 1 electrão de valência – iões monopositivos! Grupo 2 – 2 electrões de valência – iões dipositivos! Grupo 16 – 6 electrões de valência – iões dinegativos! Grupo 17 – 7 electrões de valência – iões mononegativos! Grupo 18 – de uma forma geral, não formam iões pois são muito estáveis! Em geral, o raio atómico aumenta ao longo do grupo, à medida que aumenta o número atómico e diminui ao longo do período!
- 9. Propriedades Físicas Ponto de Fusão e Ebulição Metais Alcalinos e Alcalino-Terrosos: Diminuem quando o número atómico aumenta! Diminuem ao longo do Grupo! Restantes Grupos: Aumentam com o número atómico! Aumentam ao longo do Grupo! Tarefa: Resolve todos os exercícios do manual até à página 36!
