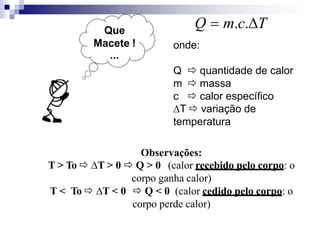
O documento discute termos relacionados à variação de entalpia (ΔH) em reações químicas. Explica que ΔH é a medida da quantidade de calor liberada ou absorvida pela reação e que ΔH é calculado como a diferença entre a entalpia dos produtos e dos reagentes. Também diferencia reações exotérmicas, que liberam calor, de reações endotérmicas, que absorvem calor, e fornece exemplos de cada tipo de reação.