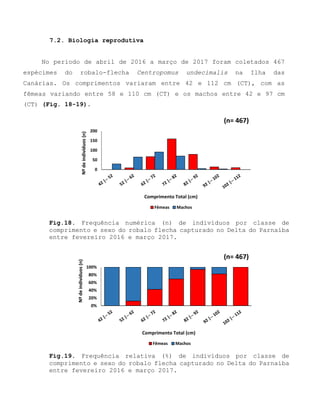
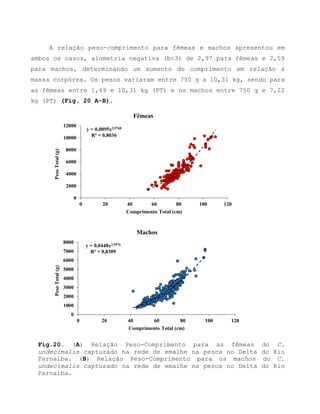
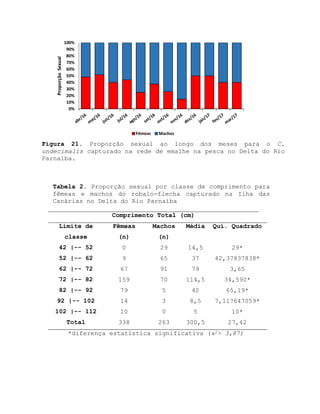
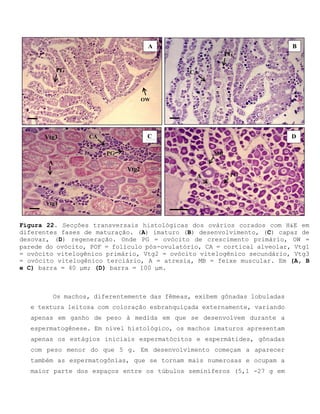
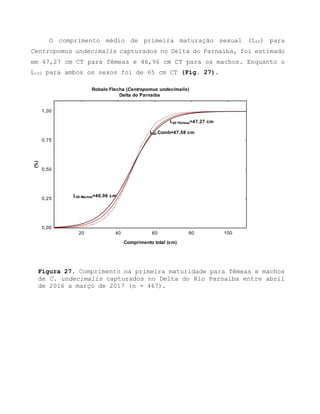
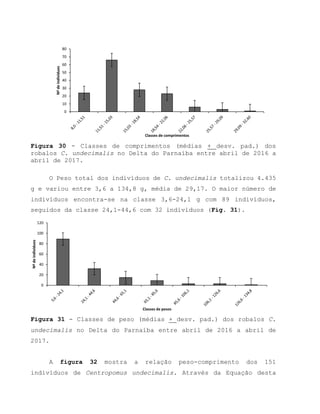
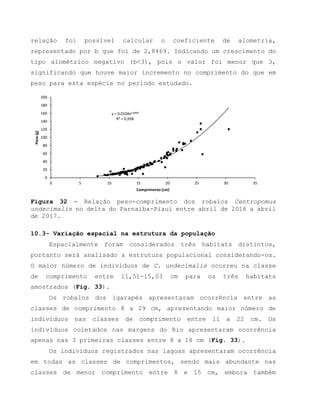
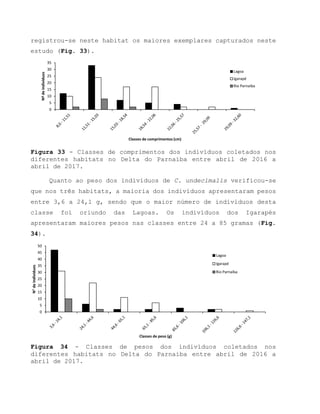
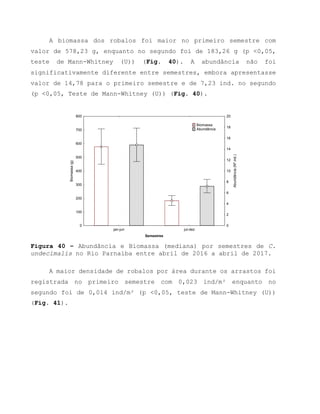
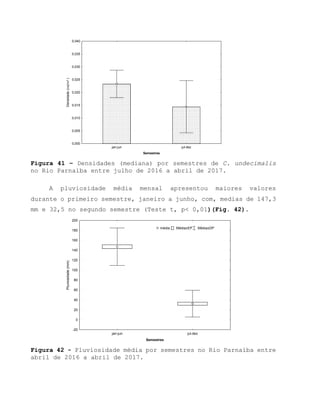
Este relatório apresenta os resultados de um estudo sobre a pesca e biologia reprodutiva do robalo-flecha na Ilha das Canárias no Delta do Parnaíba. Foram realizadas 1.482 entrevistas com pescadores para monitorar a pescaria e coletadas amostras biológicas para analisar os aspectos reprodutivos da espécie. Os dados obtidos sobre sazonalidade da pesca, esforço de pesca e parâmetros reprodutivos são cruciais para o manejo sustentável da pesca na região.
![RELATÓRIO FINAL – MONITORAMENTO DA PESCA, ESTUDO DOS ASPECTOS
REPRODUTIVOS E BIOMASSA DO ROBALO-FLECHA Centropomus undecimalis
(Bloch 1972) NA ILHA DAS CANÁRIAS
PROGRAMA PESCA PARA SEMPRE BRASIL_RESEX DELTA DO PARNAÍBA
UNIVERSIDADE FEDERAL DO PIAUÍ- UFPI
Dr. Cezar A. F. Fernandes
[Lab. de Bioecologia Pesqueira]
Dra. Francisca Edna de A. Cunha
[Lab. de Ictiologia]
10/07/2017](https://image.slidesharecdn.com/relatriofinalrarecia-170725122139/75/Relatorio-Final-Rare-Cia-1-2048.jpg)











![6.4. Análise dos dados biológicos da reprodução
Para análise das amostras biológicas, foram avaliados os
comprimento e pesos dos indivíduos, sexo, fase de maturidade sexual
e sua variação sazonal. A proporção sexual foi testada através do
teste de Chi-quadrado (P < 0,05).
Para determinação do Índice Gonadossomático (IGS) foi usada à
equação: IGS=PG/PE*100 propostas e modificada de Shaeffer e Orange
(1956) e adaptada por Maddock e Burton (1998), onde PG=peso da gônada
em gramas (g) e PE=peso eviscerado em gramas (g).
O comprimento de primeira maturação sexual (L50) foi estimado
por meio de uma curva logística à frequência relativa de indivíduos
em cada classe de comprimento (CP), de acordo com a fórmula Mf=
1/[1+exp (a+b*100*CP) ], onde MF é a fração dos indivíduos que se
encontram aptos a se reproduzirem (Beverton & Holt, 1956; Shinozaki-
Mendes et al., 2007). O ajuste dos pontos será realizado através do
método de máxima verossimilhança (maximun likelihood).
Para classificar o tipo de desenvolvimento ovocitário e o padrão
de regulação de fecundidade foram obtidas as frequências de diâmetros
dos ovócitos para cada estágio de desenvolvimento dos ovócitos e para
cada fase de maturidade sexual (Kjesbu et al., 2003).
Para fecundidade foi adotada a metodologia adaptada de Hunter
(1985), Murua et al. (2003), Kjesbu et al. (2003) e Evans et al.
(2007), fecundidade por lote “Batch fecundity” através do método
gravimétrico, onde se retira 3 amostras de 0,01 g para cada fêmea
ativamente desovando, se conta os ovócitos hidratados e se usa a
seguinte fórmula abaixo:
F=[∑ ]/𝑛 ∗ 𝑊𝑜𝑣á𝑟𝑖𝑜
𝑂𝑖
𝑊𝑖
𝑖
Onde:](https://image.slidesharecdn.com/relatriofinalrarecia-170725122139/85/Relatorio-Final-Rare-Cia-13-320.jpg)







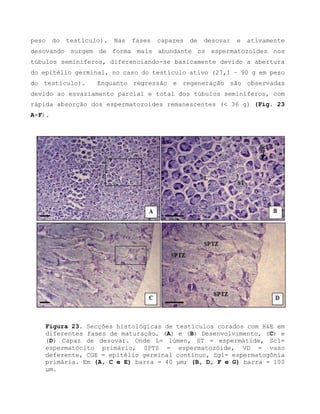
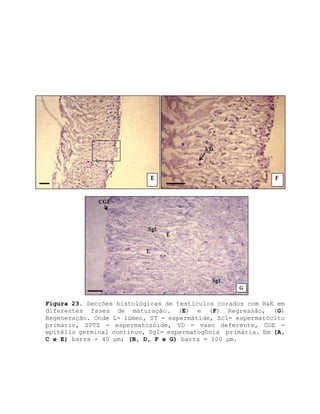










![12. Referências bibliográficas
Anderson, C. N. K., C. Hsieh, S. A. Sandin, R. Hewiit, A.
Hollowed, J. Beddington, R. M. May, and G. Sugihara. 2008.
Why fishing magnifies fluctuations in fish abundance. Nature
(London) 452:835–839.
AGOSTINHO, A. A. et al. Estraficación espacial y
comportamiento de Prochilodus scrofa en distintas fases del
ciclo de vida, en la planicie de inundación del alto río
Paraná y embalse de Itaipu, Paraná, Brasil. Revue
D'Hydrobiologie Tropicale, v. 26, n. 1, p. 79-90, 1993.
Barroso, M.V; SOUZA, G. A; THOMÉ, J. C. A; LEITE JÚNIOR, N.O;
MOREIRA, L. M.P; SANGALIA, C; SALES, E. F; DURÃO, J.N. 2007.
Estratégias de conservação das populações de robalos
Centropomus spp. na foz do Rio Doce, Linhares, Espírito Santo,
Brasil. Rev. Bras. de Agroecologia, Vol.2, No.2.
Begossi, A., Salivonchyk S.V., Araujo, L.G., Andreoli T.B.,
Clauzet, M. Martinelli C.M., Ferreira A.G.L., Oliveira
L.E.C., Silvano R.A.M. 2011. Ethnobiology of snappers
(Lutjanidae): target species and suggestions for management.
Journal of Ethnobiology and Ethnomedicine, 7:11.
Bittencourt, V. F. N. 2009. Proteção a Pesca do Robalo
(Centropomus parallelus) na Foz do Rio Mambucaba, Angra do
Reis-RJ. REVISTA - Educação Ambiental BE-597 / Volume 2, 38-
43.
Brown-Peterson, N. J., D. M. Wyanski, F. Saborido-Rey, B. J.
Macewicz, & S. K. Lowerre-Barbieri. 2011. A standardized
terminology for describing reproductive development in
fishes. Marine and Coastal Fisheries: Dynamics, Management,
and Ecosystem Science [online serial], 3:52–70.
CAVALCANTE, C. C.: O uso de habitats costeiros como berçário
de peixes no Ceará. 2014. 71f.: Dissertação (mestrado) –
Universidade Federal do Ceará, Instituto de Ciências do Mar,
Programa de Pós-Graduação em Ciências Marinhas Tropicais.
Fortaleza, 2014.
Cerqueira, V. R. Cultivo de robalo: aspectos de reprodução,
larvicultura e engorda. Editora Autor, 94 p., Florianópolis,
2002.](https://image.slidesharecdn.com/relatriofinalrarecia-170725122139/85/Relatorio-Final-Rare-Cia-61-320.jpg)

![Fisheries: Dynamics, Management, and Ecosystem Science
[online serial], 3:71–91.
Machado, M. R. F. 2011. Caracterização Morfológica e
Bioquímica do Sistema Digestório e Identificação por Isótopos
Estáveis de Robalo Peva e Flexa Selvagens e de Cativeiro.
Tese apresentada ao Programa de Pós - graduação em Aquicultura
da UNESP – Campus de Jaboticabal, como parte das exigências
para obtenção do título de Doutor(a) em Aquicultura.
Jaboticabal São Paulo – Brasil 2011.
Maddock, D. M. & M. P. Burton. 1998. Gross and histological
of ovarian development and related condition changes in
American plaice. Journal of Fish Biology, 53: 928-944.
Murua, H., G. Kraus, F. Saborido-Rey, P. R. Witthames, A.
Thorsen & S. Junquera. 2003. Procedures to estimate fecundity
in fishes. Journal of Northwest Atlantic Fishery Science,
33: 33-54.
Newman, S. J.; Cappo, M.; Williams, D. McB. 2000a. Age,
growth, mortality rates and corresponding yield estimates
using otoliths of the tropical red snappers, Lutjanus
erythropterus, L. malabaricus and L. sebae, from the central
Great Barrier Reef. Fisheries Research, 48: 1-14.
Nogueira, A. B. 2009. Biologia de Centropomus parallelus POEY,
1860 no Sistema Baía de Guaratuba, Paraná, Brasil. Dissertação
apresentada Programa de Pós-Graduação em Ciências Biológicas
– Zoologia, Setor de Ciências Biológicas da Universidade
Federal do Paraná, como requisito parcial à obtenção do título
de Mestre em Ciências Biológicas área de concentração
Zoologia.
Odum, E.P. Ecologia. Rio de janeiro: Guanabara, 1988. 434 p.
Rodrigues, P. P. R. Aspectos Reprodutivos do Robalo peba,
Centropomus parallelus, na Foz do Rio Doce, Linhares/ES.
Universidade Federal do Espírito Santo Centro de Ciências
Humanas e Naturais Departamento de Ecologia e Recursos
Naturais Curso de Graduação em Oceanografia, 2005.
Soligo, T. A. 2007. Primeiras Experiências com a Reprodução,
Larvicultura e Demame do Robalo Flexa, Centropomus
undecimalis no Brasil. Dissertação apresentada ao curso de
pós- graduação de aquicultura do centro de ciências agrárias
da Universidade Federal de Santa Catarina, como requisito](https://image.slidesharecdn.com/relatriofinalrarecia-170725122139/85/Relatorio-Final-Rare-Cia-63-320.jpg)
