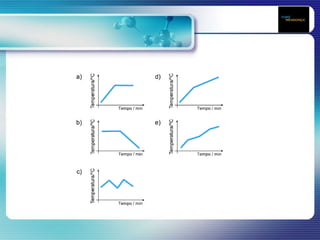
O documento apresenta 20 questões sobre conceitos de química relacionados à estrutura atômica, como modelo atômico de Rutherford, Bohr e Dalton, além de propriedades de substâncias puras e misturas. As questões abordam tópicos como número atômico, massa atômica, isótopos, elétrons, núcleo atômico, ionização, temperatura de ebulição, densidade e classificação de materiais.