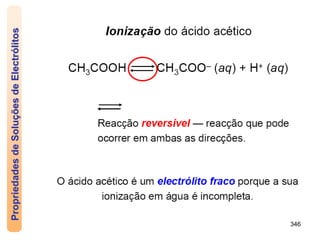
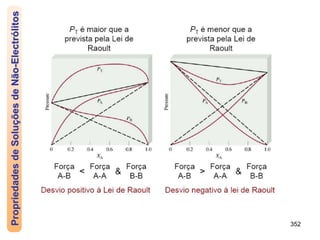
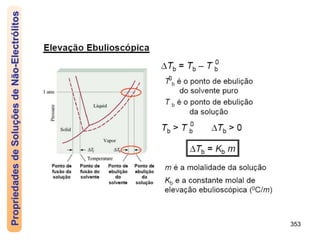
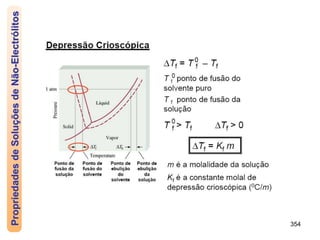
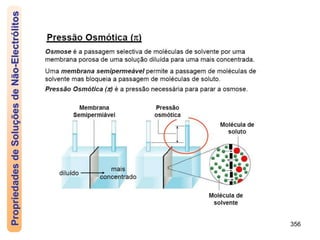
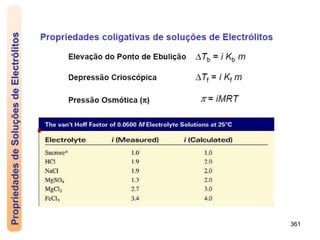
O documento discute as propriedades de soluções, incluindo:
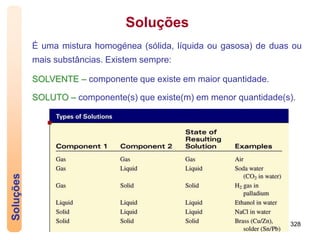
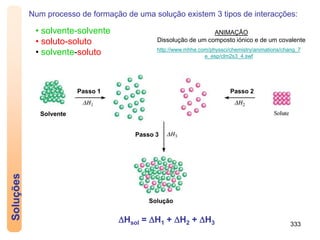
1) Uma solução é uma mistura homogénea de duas ou mais substâncias, com um solvente e um ou mais solutos.
2) Existem soluções saturadas, insaturadas e sobressaturadas, dependendo da quantidade de soluto dissolvido.
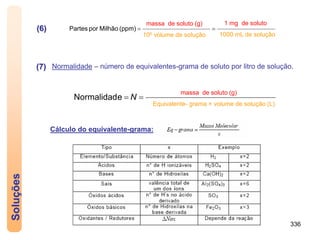
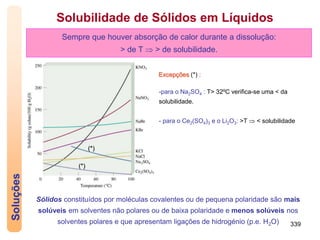
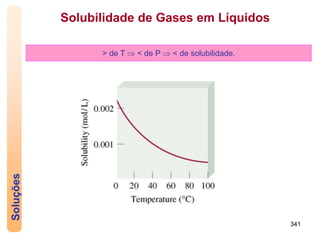
3) A solubilidade depende de fatores como a natureza das substâncias e a temperatura.