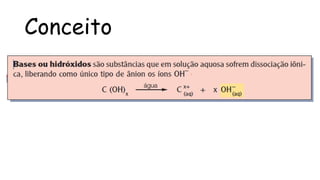
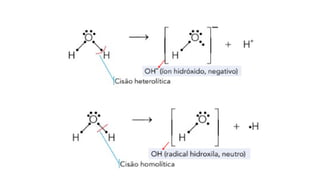
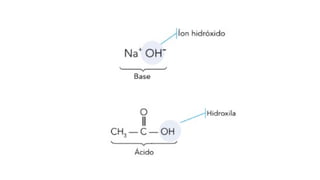
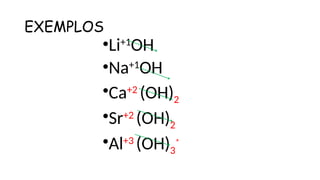
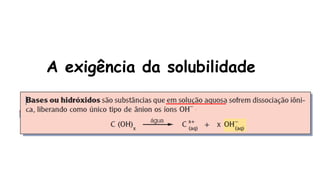
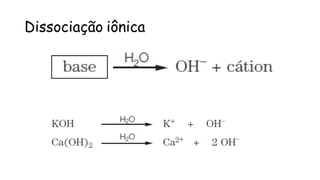
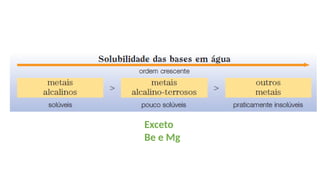
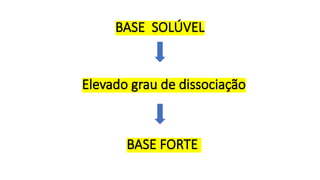
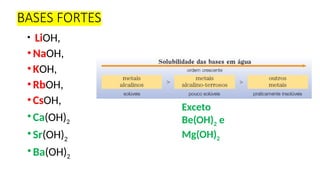
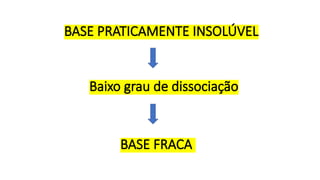
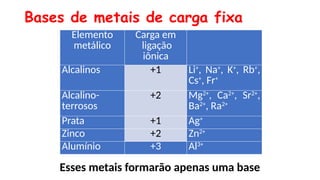
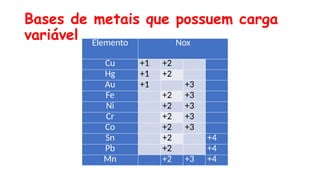
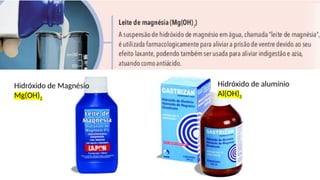
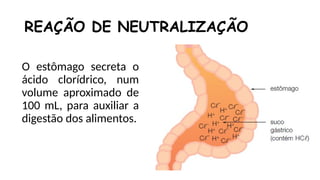
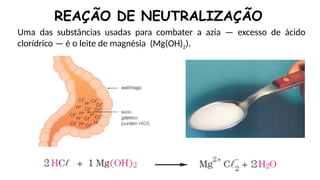
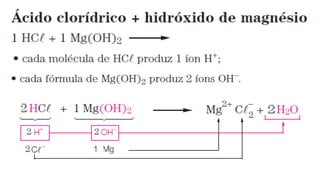
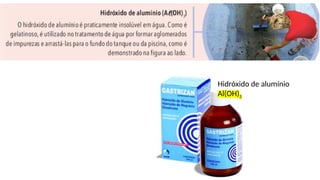
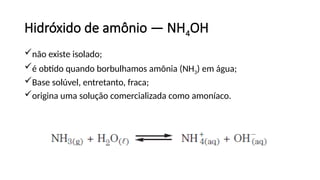
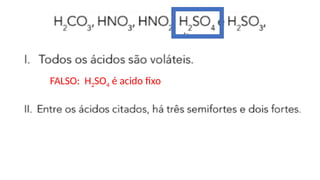
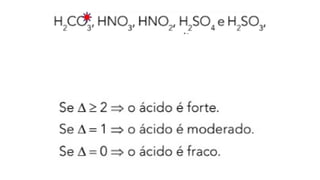
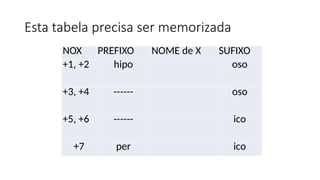
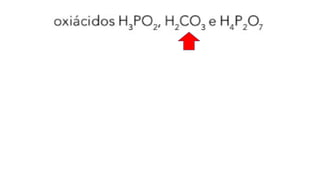
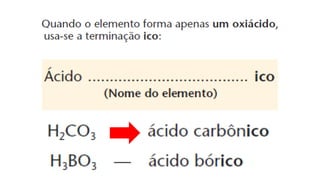
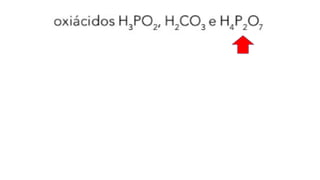
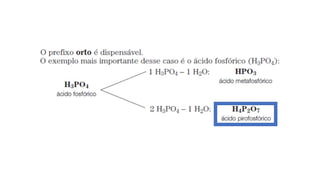
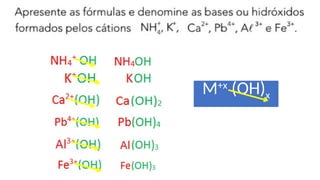
O documento aborda a classificação e características das bases inorgânicas, incluindo sua formulação, solubilidade e força. As bases são diferenciadas em monobases, dibases, tribases e tetrabases com exemplos práticos, além da volatilidade e nomenclatura de bases formadas por cátions com cargas fixas ou variáveis. Também menciona aplicações do hidróxido de sódio e hidróxido de magnésio, ilustrando suas utilidades no cotidiano, como antiácidos.