Diagrama de Fases e Termodinâmica
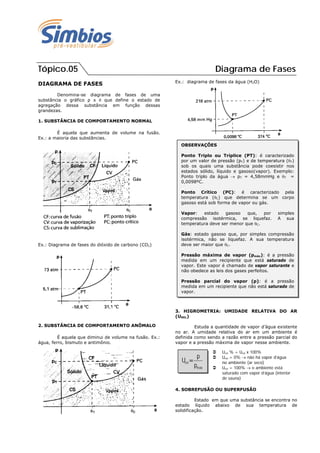
- 1. Tópico.05 Diagrama de Fases DIAGRAMA DE FASES Denomina-se diagrama de fases de uma substância o gráfico p x que define o estado de agregação dessa substância em função dessas grandezas. 1. SUBSTÂNCIA DE COMPORTAMENTO NORMAL É aquela que aumenta de volume na fusão. Ex.: a maioria das substâncias. Ex.: Diagrama de fases do dióxido de carbono (CO2) 2. SUBSTÂNCIA DE COMPORTAMENTO ANÔMALO É aquela que diminui de volume na fusão. Ex.: água, ferro, bismuto e antimônio. Ex.: diagrama de fases da água (H2O) 3. HIGROMETRIA: UMIDADE RELATIVA DO AR (UREL) Estuda a quantidade de vapor d’água existente no ar. A umidade relativa do ar em um ambiente é definida como sendo a razão entre a pressão parcial do vapor e a pressão máxima de vapor nesse ambiente. 4. SOBREFUSÃO OU SUPERFUSÃO Estado em que uma substância se encontra no estado líquido abaixo de sua temperatura de solidificação. OBSERVAÇÕES Ponto Triplo ou Tríplice (PT): é caracterizado por um valor de pressão (pT) e de temperatura (T) sob os quais uma substância pode coesistir nos estados sólido, líquido e gasoso(vapor). Exemplo: Ponto triplo da água pT = 4,58mmHg e T = 0,0098ºC. Ponto Crítico (PC): é caracterizado pela temperatura (C) que determina se um corpo gasoso está sob forma de vapor ou gás. Vapor: estado gasoso que, por simples compressão isotérmica, se liquefaz. A sua temperatura deve ser menor que C. Gás: estado gasoso que, por simples compressão isotérmica, não se liquefaz. A sua temperatura deve ser maior que C. Pressão máxima de vapor (pmáx): é a pressão medida em um recipiente que está saturado de vapor. Este vapor é chamado de vapor saturante e não obedece as leis dos gases perfeitos. Pressão parcial do vapor (p): é a pressão medida em um recipiente que não está saturado de vapor. máx rel p p U Urel % = Urel x 100% Urel = 0% não há vapor d’água no ambiente (ar seco) Urel = 100% o ambiente está saturado com vapor d’água (interior de sauna)
- 2. A sobrefusão é um estado metaestável, ou seja, em que existe aparentemente equilíbrio, mas a há uma passagem muito lenta para outro estado. Uma simples agitação, ou mesmo a introdução de uma pequena porção sólida, perturba o fenômeno e provoca uma brusca solidificação parcia ou total do líquido. A temperatura eleva-se até o ponto de solidificação. Essa elevação de temperatura é provocada pelo calor liberado pela parte do líquido que se solidifica (a solidificação é uma transformação exotérmica). Veja o gráfico que representa um resfriamento com supefusão: Onde: m é a massa solidificada; M é a massa total do do líquido; LS é o calor latente de solidificação; S é a temperatura de solidificação; é a temperatura de superfusão. 01. (Fuvest/SP) Enche-se uma seringa com pequena quantidade de água destilada a uma temperatura um pouco abaixo da temperatura de ebulição. Fechando o bico, como mostra a figura A a seguir, e puxando rapidamente o êmbolo, verifica-se que a água entra em ebulição durante alguns instantes (veja figura B). Podemos explicar este fenômeno considerando que: a) na água há sempre ar dissolvido e a ebulição nada mais é do que a transformação do ar dissolvido em vapor. b) com a diminuição da pressão a temperatura de ebulição da água fica menor do que a temperatura da água na seringa. c) com a diminuição da pressão há um aumento da temperatura da água na seringa. d) o trabalho realizado com o movimento rápido do êmbolo se transforma em calor que faz a água ferver. e) calor específico da água diminui com a diminuição da pressão. 02. Quando passamos éter sobre a pele sentimos o local mais frio. Isto acontece por que: a) o éter está a uma temperatura mais baixa que a pele b) o éter está a uma temperatura mais baixa que o ar c) o éter é muito volátil d) o éter absorve calor para se vaporizar e) o éter é um isolante térmico 03. (ITA/SP) Considere as seguintes afirmativas: I. Um copo de água gelada apresenta gotículas de água em sua volta porque a temperatura da parede do copo é menor que a temperatura de orvalho do ar ambiente. II. A névoa (chamada por alguns de "vapor") que sai do bico de uma chaleira com água quente é tanto mais perceptível quanto menor for a temperatura ambiente. III. Ao se fechar um "freezer", se sua vedação fosse perfeita, não permitindo a entrada e a saída de ar de seu interior, a pressão interna ficaria inferior à pressão do ar ambiente. a) todas são corretas. b) somente I e II são corretas. c) somente II e III são corretas. d) somente I e III são corretas. e) nenhuma delas é correta. 04. (Unicamp/SP) No Rio de Janeiro (ao nível do mar), uma certa quantidade de feijão demora 40 minutos em água fervente para ficar pronta. A tabela adiante fornece o valor da temperatura da fervura da água em função da pressão atmosférica, enquanto a gráfico fornece o tempo de cozimento dessa quantidade de feijão em função da temperatura. A pressão atmosférica ao nível do mar vale 760 mm de mercúrio e ela diminui 10 mm de mercúrio para cada 100 m de altitude. Temperatura de fervura da água em função da pressão Pressão Temp. Pressão Temp. (mmHg) (ºC) (mmHg) (ºC) 600 94 840 103 640 95 880 105 680 97 920 106 720 98 960 108 760 100 1000 109 m.LS = M.clíq.( - S) EXERCÍCIOS PROPOSTOS
- 3. 800 102 1040 110 a) Se o feijão fosse colocado em uma panela de pressão a 880 mm de mercúrio, em quanto tempo ele ficaria pronto? b) Em uma panela aberta, em quanto tempo o feijão ficará pronto na cidade de gramado (RS) na altitude de 800 m ? c) Em que altitude o tempo de cozimento do feijão (em uma panela aberta) será o dobro do tempo de cozimento ao nível do mar 05. (UFF/RJ) Marque a opção que apresenta a afirmativa falsa: a) uma substância não existe na fase líquida quando submetida a pressões abaixo daquela de seu ponto triplo b) a sublimação de uma substância é possível se esta estiver submetida a pressões mais baixas que a do seu ponto triplo c) uma substância só pode existir na fase líquida se a temperatura a que estiver submetida for mais elevada que sua temperatura crítica d) uma substância não sofre condensação a temperaturas mais elevadas que sua temperatura crítica e) na Lua, um bloco de gelo pode passar diretamente para fase gasosa 06. (Fuvest/SP) Quando água pura é cuidadosamente resfriada, nas condições normais de pressão, pode permanecer no estado líquido até temperaturas inferiores a 0°C, num estado instável de "superfusão". Se o sistema é perturbado, por exemplo, por vibração, parte da água se transforma em gelo e o sistema se aquece até se estabilizar em 0°C. O calor latente de fusão da água é L = 80 cal/g. Considerando-se um recipiente termicamente isolado e de capacidade térmica desprezível, contendo um litro de água a -5,6°C, à pressão normal, determine: a) A quantidade, em g, de gelo formada, quando o sistema é perturbado e atinge uma situação de equilíbrio a 0°C. b) A temperatura final de equilíbrio do sistema e a quantidade de gelo existente (considerando-se o sistema inicial no estado de "superfusão" a -5,6°C), ao colocar-se, no recipiente, um bloco metálico de capacidade térmica C=400cal/°C, na temperatura de 91°C.
- 4. Tópico.06 Gases e Termodinâmica TERMODINÂMICA É o ramo da termologia que procura estabelecer as condições de equilíbrio entre um sistema (uma amostra de gás, por exemplo), relacionando as quantidades de calor (Q) trocadas com a variação de energia interna (U) e os trabalhos ( ) realizados durante o processo. 1. QUANTIDADE DE CALOR (Q) Nos tópicos anteriores as trocas de calor foram amplamente discutidas. Vamos aqui apenas relembrar a sua convenção de sinais. Q > 0: O sistema (gás) recebe calor; Q < 0: O sistema (gás) perde calor; Q = 0: O sistema (gás) não troca calor; (TRANSFORMAÇAO ADIABÁTICA) 2. VARIAÇÃO DE ENERGIA INTERNA (U) Energia Interna (U): é o somatório das energias cinéticas de translação, rotação e vibração das moléculas, da energia potencial de interação molecular e a energia dos elétrons. Não havendo mudança de estado, a energia interna é função exclusiva da temperatura absoluta. Onde: T é a temperatura em Kelvin R é a constante universal do gás ideal (R = 0,082atm.L/mol.K = 8,31J/mol.K) n é o nº de mols grama.moléc massa n U = U – U0 ou 2. TRABALHO () pressão constante Onde: é o trabalho em J P é a pressão em N/m2 (=Pa) V é a variação de volume em m3 V = V–V0 T.R.n 2 3 U T.R.n 2 3 U = p.V V0 V V F d OBSERVAÇÕES 1) Temperatura aumenta Energia interna aumenta U > 0 2) Temperatura diminui Energia interna diminui U < 0 3) Temperatura constante Energia interna constante U = 0 4) Numa mudança de estado, a temperatura não varia, mas a energia interna varia de acordo com a quantidade de calor que o sistema recebe ou perde; 5) A variação da energia interna não depende do processo, depende apenas das temperaturas inicial e final do processo. OBSERVAÇÕES 1) A equação = p.V só é válida se a pressão for constante. 2) Se V aumenta (expansão) V > 0 > 0 “O gás (sistema) realiza trabalho sobre o meio externo”. F F 3) Se V diminui (contração) V < 0 < 0 “O meio externo realiza trabalho sobre o gás (sistema)”. F F 4) Se V constante V = 0 = 0 (TRANSFORMAÇAO ISOCÓRICA, ISOMÉTRICA OU ISOVOLUMÉTRICA)
- 5. 3. DIAGRAMA P X V Na expansão V e > 0 Na contração V e < 0 4. PRIMEIRA LEI DA TERMODINÂMICA Representa o princípio da conservação da energia para sistemas termodinâmicos. 5. TRANSFORMAÇÕES CÍCLICAS Como em uma transformação cíclica a temperatura de início do ciclo é igual a temperatura final do ciclo podemos concluir que: Da 1ª Lei da termodinâmica temos que: 6. ESTUDO DOS GASES a) Equação de Clapeyron Onde: P é a pressão V é o volume T é a temperatura em Kelvin R é a constante universal do gás ideal (R=0,082atm.L/mol.K=8,31J/mol.K) n é o nº de mols grama.moléc massa n b) Lei Geral do Gás Perfeito (L.G.G.P) 7. TRANSFORMAÇÕES GASOSAS PARTICU- LARES a) Isobárica p constante V variável 0 T variável U 0 L.G.G.P. : 1ª Lei da termodinâmica: U = Q - 0 V0 V A equação = p . V só é válida para p constante, mas o cálculo do trabalho através da área do diagrama p x V não tem restrições, ou seja, pode ser utilizado tanto para p constante como para p variável. Calor (Q) Trabalho U Q = + U U = Q - CICLO = Área N CICLO > 0 CICLO < 0 U CICLO = 0 Área pressão Volume 0 v0 v Área pressão Volume 0 v0 v p . V = n . R . T 2 2 1 1 T V T V Área p pressão Volume = Área p x V N B C P V Área CICLO A D U CICLO = Q CICLO - CICLO Q CICLO = CICLO 2 22 1 11 T V.p T V.p OBSERVAÇÃO Qp = m.cP. onde cP é o calor específico a pressão constante. Como M.nm M m n daí temos que: QP = n.M.cP. onde M.cP é o Calor Molar a pressão constante(CP) CP = M.cP, e então:
- 6. Gráficos Gráfico V x T b) Isocórica, Isométrica ou Isovolumétrica V constante = 0 p variável T variável U 0 1ª Lei da termodinâmica: U = Q - como = 0 Recebe Calor (Q > 0) Aumenta Temperatura (U > 0) e pressão. Perde Calor (Q < 0) Diminui Temperatura (U < 0) e pressão. L.G.G.P. : Gráficos Gráfico p x V Gráfico p x T c) Isotérmica T constante U = 0 p variável V variável 0 1ª Lei da termodinâmica: U = Q - como U = 0 Recebe Calor (Q > 0) Aumenta Volume (expansão > 0) e diminui pressão EXPANSÃO ISOTÉRMICA. Perde Calor (Q < 0) Diminui Volume (contração < 0) e aumenta pressão (compressão) CONTRAÇÃO ou COMPRESSÃO ISOTÉRMICA. L.G.G.P. : Gráficos U = Q = Q p1 .V1 = p2 .V2 V T ( K )0 - 273 0 V T ( ºC ) 2 2 1 1 T p T p OBSERVAÇÃO QV = m.cV. onde cP é o calor específico a volume constante. Como M.nm M m n daí temos que: Qv = n.M.cv. onde M.cP é o Calor Molar a volume constante(Cv) Cv = M.cv, e então: Qv = n.Cv. P V 0 V T ( ºC ou K)0 Gráfico p x V Gráfico V x T p T ( K )0 - 273 0 p T ( ºC ) Gráfico p x T 0 p T ( ºC ou K) Gráfico p x T Gráfico V x T 0 V T ( ºC ou K) P V 0 P T ( ºC ou K)0
- 7. As curvas T1 e T2 são hipérboles equiláteras chamadas de ISOTERMAS de temperaturas respectivamente iguais a T1 e T2 . T2 > T1 pois quanto maior o produto p.V, maior a temperatura d) Adiabática É uma transformação gasosa em que o gás não troca calor com o meio externo (Q = 0). Isso ocorre em transformações gasosas rápidas ou em sistemas termicamente isolados. 1ª Lei da termodinâmica: U = Q - como Q = 0 Aumenta Volume (expansão > 0) Diminui Temperatura (U < 0) e pressão EXPANSÃO ADIABÁTICA. Diminui Volume (contração < 0) Aumenta Temperatura (U > 0) e pressão (compressão). CONTRAÇÃO ou COMPRESSÃO ADIABÁTICA. Gráfico p x V 1. Um sistema gasoso passa de um estado A para um outro estado B. Nesse processo, ele troca calor e trabalho com a sua vizinhança. Adote 1cal=4J e calcule a variação da energia interna do sistema nos seguintes casos: a) O sistema absorve 2000 calorias de calor e realiza um trabalho de 3000J. b) O sistema absorve 2000 calorias de calor e um trabalho de 3000J é realizado sobre ele. c) O sistema cede 2000 calorias de calor e um trabalho de 3000J é realizado sobre ele. 2. (UFPE/PE) Um gás ideal realiza o processo ABC indicado no diagrama PV, abaixo. Na transformação isotérmica BC, onde a temperatura permanece constante, o gás absorve 1,4×105 J de calor. Qual o trabalho total realizado pelo gás, em joules, durante a transformação ABC? U = – p V0 T1 T2 A B Gráfico p x V OBSERVAÇÕES 1) A curva adiabática é uma curva exponencial, caracterizada pela equação: p . V = K Onde: coeficiente de Poisson v P C C K é uma constante; 2) Em uma transformação adiabática, entre dois estados A e B, vale a relação: pA . V A = pB . V B 3) Nas transformações isotérmicas = 1 e a curva é uma hipérbole. 4) CP – CV = R é a Relação de Mayer onde CP > CV. EXERCÍCIOS PROPOSTOS T2 p V0 T1 Adiabática T1 e T2 são isotermas
- 8. 3. Um gás sofre a transformação cíclica ABCA, indicada no gráfico a seguir. A variação da energia interna e o trabalho realizado pelo gás, valem, respectivamente: a) 0 J e 0 J b) 0 J e 8,0 x 102 J c) 0,5 x 102 J e 1,5 x 103 J d) 8,0 x 102 J e 0 J e) 8,5 x 102 J e 8,0 x 102 J 4. O gráfico representa uma transformação AB sofrida por 1,0 mol de um gás ideal. Sendo a constante universal do gás ideal 8,3J/mol.K, determine: a) as temperaturas do gás nos estados A e B; b) as energias internas dos estados A e B; c) a variação da energia interna na transformação AB; d) o trabalho realizado na transformação AB; e) a quantidade de calor trocada com o meio externo durante a transformação AB. 5. (UFG/GO) Um recipiente, em contato com uma fonte térmica, contém um gás ideal, confinado em seu interior devido à presença de um êmbolo que pode deslizar sem atrito, como mostra a figura a seguir. Calcule a quantidade de calor fornecida pela fonte, em um segundo, para que a temperatura do gás não se altere. Considere g=10m/s2 e que êmbolo, de massa igual a 2kg, movimenta-se verticalmente para cima, com velocidade constante e igual a 0,4m/s. 6. (Unicamp/SP) Um mol de gás ideal sofre transformação ABC indicada no diafragma pressão x volume da figura a seguir. a) qual é a temperatura do gás no estado A? b) Qual é o trabalho realizado pelo gás na expansão AB? c) qual é a temperatura pelo gás no estado C? Dado: R (constante dos gases) = 0,082 atm.L/mol.K = 8,3J/mol K 7. (UFMG/MG) Como conseqüência da compressão adiabática sofrida por um gás, pode-se afirmar que a) a densidade do gás aumenta, e sua temperatura diminui. b) a densidade do gás e sua temperatura diminuem. c) a densidade do gás aumenta, e sua temperatura permanece constante. d) a densidade do gás e sua temperatura aumentam. e) a densidade do gás e sua temperatura permanecem constantes. 8. (UEL/PR) Considere as proposições a seguir sobre transformações gasosas. I. Numa expansão isotérmica de um gás perfeito, sua pressão aumenta. II. Numa compressão isobárica de um gás perfeito, sua temperatura absoluta aumenta. III. Numa expansão adiabática de um gás perfeito, sua temperatura absoluta diminui. Pode-se afirmar que apenas a) I é correta. b) II é correta. c) III é correta. d) I e II são corretas. e) II e III são corretas. p (10 4 N/m 2 ) 3 2 0 200 400 V (L)
- 9. 9. (Mackenzie/SP) Com relação às transformações sofridas por um gás perfeito, assinale a alternativa INCORRETA. a) Na transformação adiabática, a variação de energia cinética das moléculas é nula b) Na transformação isobárica, não há variação da pressão do gás. c) Na transformação isotérmica, a energia cinética média das moléculas não se altera. d) Na transformação adiabática, não há troca de calor com o meio exterior. e) Na transformação isotérmica, há troca de calor com o meio exterior. 10. (UFMG/MG) O gráfico da pressão p em função do volume V de um gás ideal representa uma transformação cíclica ocorrida em três fases. Inicia-se o ciclo por uma transformação isobárica, seguida de uma transformação isovolumétrica e finalmente, de uma transformação isotérmica. Com base nesses dados pode-se afirmar que a) o trabalho realizado na transformação isotérmica é calculado pela expressão p3(V1-V3). b) o trabalho realizado pelo gás é nulo durante a transformação isotérmica. c) o trabalho realizado pelo gás na transformação isotérmica é igual ao calor que esse gás absorve. d) o trabalho realizado sobre o gás durante a transformação isovolumétrica é o mesmo que na transformação isobárica. e) o trabalho realizado sobre o gás, na transformação isovolumétrica, é maior do que o trabalho realizado pelo gás na transformação isotérmica. 11. (UnB/DF) O calor, uma das mais importantes formas conhecidas de energia, pode ser aproveitado de diversas maneiras: no aquecimento de ambientes ou de água; em usinas térmicas, para a geração de energia elétrica; nas locomotivas a vapor, para o transporte de passageiros e de carga; etc. Assim, devido à grande importância da energia calorífica, desenvolveram-se diversos sistemas que possibilitam a sua utilização. O diagrama adiante representa um desses sistemas. Considere que, na passagem do estado A para o estado B, segundo a trajetória ACB, esse sistema receba 40 kcal de calor e realize 15kcal de trabalho, e julgue os seguintes itens. (1) Se, na passagem do estado A para o estado B, o caminho seguido for ADB e o trabalho realizado for igual a 5kcal, a quantidade de calor recebida pelo sistema será igual a 30kcal. (2) Se, na passagem do estado B para o estado A, ao longo da curva BA, o sistema realizar 10kcal de trabalho, então ele liberará 35kcal de calor. (3) Se a energia interna, no estado A, é igual a zero e, no estado D, igual a 20kcal, então o calor absorvido pelo sistema, no processo DB, é igual a 5kcal. (4) Os trabalhos realizados pelo sistema nos trajetos ACBA e ADBA são iguais. (5) O funcionamento dos pistões (êmbolos) de uma locomotiva a vapor baseia-se em sucessivas transformações dos tipos AC e CA. 12. (UFRJ/RJ) A figura representa, num gráfico pressão × volume, um ciclo de um gás ideal. a) Calcule o trabalho realizado pelo gás durante este ciclo. b) Calcule a razão entre a mais alta e a mais baixa temperatura do gás (em kelvin) durante este ciclo. 13. (Fuvest/SP) Um cilindro contém uma certa massa M0 de um gás a T0 = 7 ºC (280 K) e pressão P0. Ele possui uma válvula de segurança que impede a pressão interna de alcançar valores superiores a P0. Se essa pressão ultrapassar P0, parte do gás é liberada para o ambiente. Ao ser aquecido até T = 77 ºC (350 K), a válvula do cilindro libera parte do gás, mantendo a pressão interna no valor P0. No final do aquecimento, a massa de gás que permanece no cilindro é, aproximadamente, de: a) 1,0 M0 b) 0,8 M0 c) 0,7 M0 d) 0,5 M0 e) 0,1 M0 14. (UFG/GO) Uma caixa térmica rígida e hermeticamente fechada contém um mol de ar a 27 ºC e 1 atm. Se 100 g de mercúrio a 327 ºC forem injetados na caixa, calcule a pressão e a temperatura do ar após o equilíbrio térmico ter sido atingido. Despreze a capacidade térmica da caixa e a variação de volume do ar com a injeção do mercúrio. (Dados: calor molar do ar a volume constante = 21 J/mol K; calor específico do mercúrio líquido = 0,14 J/g K.) 15. (UFG/GO/2007) Transformações termodinâmicas, realizadas sobre um
- 10. gás de número de mols constante que obedece à lei geral dos gases ideais, são mostradas na figura abaixo. As transformações I, II e III são, respectivamente, a) adiabática, isobárica e isotérmica. b) isobárica, adiabática e isotérmica. c) isotérmica, isobárica e adiabática. d) adiabática, isotérmica e isobárica. e) isotérmica, adiabática e isobárica. 16. (UFG/GO/2007) A figura abaixo mostra o comportamento de n mols de um gás ideal numa expansão adiabática AB entre as isotermas TA e TB. Dado: 3 5 C C V P Com base no gráfico, calcule: a) A pressão pB. b) A temperatura TB. GABARITO TÓPICO.05.DIAGRAMA.DE.FASES 1) b; 2) d; 3) a; 4) a) 20min; b) 60min; c) 1200m; 5) c; 6) a) 70g; b) 22ºC; massa de gelo nula. TÓPICO.06.GASES.E.TERMODINÂMICA 1) 2) 2,4.10 5 J 3) B; 4) 5) 8J 6) a) 293 K; b) 6,1.10 2 J; c)293 K. 7) D 8) C 9) A 10) C 11) CCCEE 12) a) 1,0 × 10 -7 J; b) TB /TD = 4,5. 13) B 14) 147ºC e 1,4atm 15) A 16)
