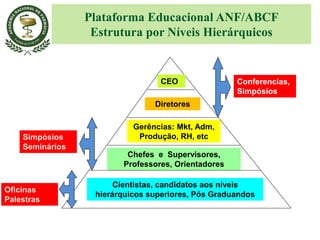
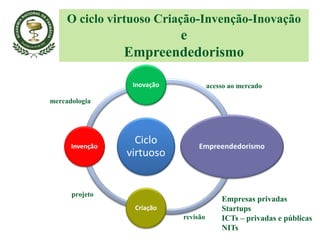
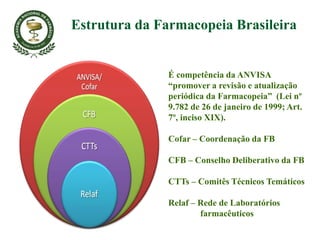
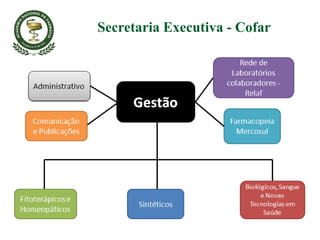
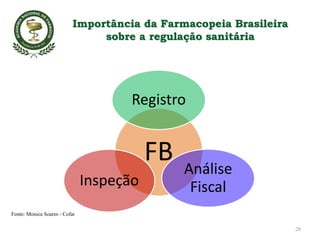
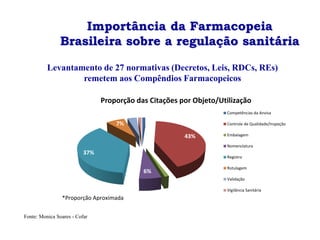
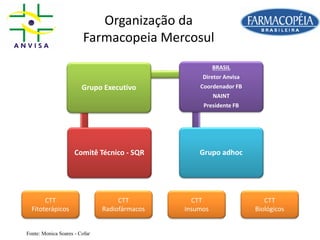
O documento discute a importância da Farmacopeia Brasileira e da regulamentação de embalagens primárias para medicamentos. Apresenta a estrutura e objetivos da Academia Nacional de Farmácia e da Farmacopeia Brasileira, além de resumir as principais monografias relacionadas a embalagens primárias e os testes realizados nelas.