Este documento é a 5a edição da Farmacopeia Brasileira, publicada em 2010 pela Agência Nacional de Vigilância Sanitária (Anvisa). A Farmacopeia Brasileira estabelece normas e especificações para insumos farmacêuticos, medicamentos e outros produtos sujeitos à vigilância sanitária no Brasil. Esta edição foi elaborada pela Comissão da Farmacopeia Brasileira e contém 176 métodos gerais e 599 monografias.

























































































![90 Farmacopeia Brasileira, 5ª edição
5
VISCOSÍMETRO DE EFLUXO - MODELO TIPO FORD
Selecionar o orifício adequado. A diretriz para a seleção do
orifício deve ser a obtenção de um tempo de escoamento
do líquido em teste ao redor de 60 segundos. Deve-se ter
um tempo de escoamento entre 20 e 100, segundos, para a
amostra a 25 ºC.
A amostra deve ser, perfeitamente, homogeneizada. No
momento do ensaio, o viscosímetro e o material a ser
ensaiado devem estar a 25 ± 0,1 ºC. Fechar o orifício com
lâmina de vidro plana e preencher o copo com amostra
até o nível mais elevado. Verter a amostra, lentamente,
evitando a formação de bolhas. Nivelar a amostra no
copo utilizando placa de vidro plana. Retirar a lâmina do
orifício. A amostra ficará retida dentro do copo. Remova
a placa de vidro plana e acione o cronômetro quando a
amostra começar a escoar pelo orifício. Quando ocorrer
a primeira interrupção do fluxo de escoamento, parar o
cronômetro e anotar o tempo transcorrido em segundos.
Realizar o ensaio, no mínimo, em triplicata. A viscosidade
será a média dos valores obtidos, expressa em mm2
/s ou
Centistokes, sendo permitido um desvio padrão máximo
3%. A conversão de segundos para mm2
/s ou Centistokes
é dada de acordo com o manual do equipamento utilizado.
5.2.8 DETERMINAÇÃO
DO PODER ROTATÓRIO
E DO PODER ROTATÓRIO
ESPECÍFICO
Muitas substâncias farmacêuticas são opticamente ativas,
logo desviam a luz plano-polarizada de modo que a luz
transmitida é desviada em um determinado ângulo em
relação à incidente.
Substâncias com a mesma estrutura contendo um ou mais
centros quirais as quais são imagens especulares não
superponíveisumadaoutrasãodenominadasenantiômeros.
Um dos enantiômeros desvia a luz plano-polarizada para
a direita (+) e é chamado de dextrógiro, ou d; o antípoda
desvia para a esquerda (-) e é conhecido como levógiro
ou l. O ângulo desse desvio é igual em módulo para os
enantiômeros, porém com sinais opostos.
As propriedades físico-químicas dos enantiômeros como
densidade, índice de refração, momento dipolo-dipolo,
pontos de ebulição e fusão são idênticas já que o ambiente
químico no qual está inserido cada átomo é igual para os
enantiômeros.
A polarimetria, isso é, a medição do poder rotatório de
uma substância com polarímetro é um dos métodos mais
prático para distinguir os enantiômeros e, portanto, é um
importante critério de identificação, caracterização e de
determinação de pureza enantiomérica dos fármacos.
O poder rotatório varia com a temperatura, o comprimento
de onda da luz incidente, o solvente utilizado, a natureza da
substância e sua concentração. Se a solução contiver duas
substâncias opticamente ativas e estas não reagirem entre
si, o ângulo de desvio será a soma algébrica dos ângulos de
desvio de ambas.
Polarímetro
Historicamente, a polarimetria foi realizada utilizando
um instrumento em que o poder rotatório é estimado pela
visualização da intensidade de campos divididos. Por essa
razão, a linha-D da lâmpada de sódio no comprimento de
onda visível a 589 nm foi o mais frequentemente utilizado.
O poder rotatório específico determinado na linha D é
expresso, na maioria das vezes, pelo símbolo:
O uso de comprimentos de onda mais baixos como os
disponíveis com as linhas de lâmpada de mercúrio isolados
por meio de filtros de transmitância máxima a cerca de 578,
546, 436, 405 e 365 nm em um polarímetro fotoelétrico
mostraram maior sensibilidade; consequentemente houve
uma redução na concentração da substância no ensaio.
Em geral, o poder rotatório observado em 436 nm é
aproximadamente o dobro e em 365 nm é cerca de três
vezes maior que o em 589 nm.
Poder rotatório e poder rotatório especifico
A equação geral usada em polarimetria é:
Em que [α] é o poder rotatório específico no comprimento
de onda λ e na temperatura t, a é o poder rotatório observado
em graus (°), l é o caminho óptico em decímetros e c é a
concentração da substância em g por 100 mL. Assim, [α]
é 100 vezes α para uma solução contendo 1 g em 100 mL
em uma célula com um caminho óptico de 1,0 decímetro
sob condições definidas do comprimento de onda da luz
incidente e da temperatura.
Procedimento
O poder rotatório específico de um fármaco é um valor de
referência e deve ser calculado a partir do poder rotatório
observado para a solução da amostra ou para o líquido
conforme especificado na monografia. As medidas do poder
rotatório são realizadas a 589 nm a 20 °C exceto quando
especificado. Sempre que um polarímetro fotoelétrico é
usado, uma única medida corrigida pelo branco é realizada.
Para um polarímetro visual é empregada a média de pelo
menos cinco determinações corrigidas pelo branco. Em
ambos os casos, o solvente utilizado para o preparo da
solução da amostra deve ser utilizado como branco ou o tubo
vazio no caso de líquidos. A temperatura experimental deve
ser mantida em ± 0,5 °C em relação ao valor especificado.
Usar o mesmo tubo do polarímetro na mesma orientação
angular para a amostra e o branco. Posicionar o tubo para
que a luz passe por ele na mesma direção cada vez.](https://image.slidesharecdn.com/volume1-130912135211-phpapp01/85/Volume-1-90-320.jpg)






























![121Farmacopeia Brasileira, 5ª edição
5
Figura 3 - Polarograma obtido na
polarografia de pulso diferencial.
Por outro lado, a técnica de pulsos não provoca diminuição
acelerada da camada de difusão (concentração de espécies
eletroativas junto ao eletrodo), propiciando a obtenção de
correntes de difusão mais elevadas para concentrações
equivalentes. Daí o aumento de sensibilidade inerente à
técnica. Outro aspecto favorável da polarografia de pulso é
a maior facilidade na medida da corrente limite, isenta de
oscilações, ao contrário do que ocorre na polarografia de
corrente contínua.
Na polarografia de pulso diferencial, pulsos constantes,
de pequena amplitude, são sobrepostos a uma rampa de
potencial de tensão linearmente crescente. A medida da
corrente é efetuada duas vezes a cada pulso - imediatamente
antes da aplicação do pulso e, novamente, em seu instante
final-registrando-seapenasadiferençaentreosdoisvalores
medidos (Figura 2). O registro gráfico deste sistema de
medida diferencial fornece curva semelhante à derivada da
onda polarográfica, mostrando pico característico (Figura
3). O potencial do pico polarográfico corresponde a E1/2
- DE/2 em que DE representa a altura do pico. Graças à
natureza do polarograma, que apresenta picos em vez
de ondas polarográficas tradicionais, a polarografia de
pulso diferencial propicia resolução mais elevada, a
ponto de permitir determinações simultâneas de espécies
eletroativas com potenciais de meia-onda próximos entre
si, em concentrações da ordem de 10-7
M.
5.2.19 DETERMINAÇÃO DO pH
DETERMINAÇÃO POTENCIOMÉTRICA DO pH
O valor de pH é definido como a medida da atividade
do íon hidrogênio de uma solução. Convencionalmente
é usada a escala da concentração de íon hidrogênio da
solução. A água é um eletrólito extremamente fraco, cuja
autoionização produz íon hidrônio (hidrogênio hidratado)
e íon hidróxido:
H2
O + H2
O H3
O+
+ OH-
As concentrações do íon hidrônio nas soluções aquosas
podem variar entre limites amplos, que experimentalmente
vão de 1 a 10-14 M, que é definida pela simplificada
relação:
pH = - log [H3
O+
]= log 1/[H3
O+
],
Desta forma, a escala de pH é uma escala invertida em
relação às concentrações de íon hidrônio, ou seja, quanto
menor a concentração de íon hidrônio, maior o valor do
pH.
A determinação potenciométrica do pH é feita pela
medidada diferença de potencial entre dois eletrodos
adequados, imersos na solução em exame. Um destes
eletrodos é sensível aos íons hidrogênio e o outro é o
eletrodo de referência, de potencial constante.
A equação que expressa a medida potenciométrica de uma
célula é :
pH = pHt
= (E –Et
)/ K,
em que
E = potencial medido quando a célula contém a solução
amostra,
Et = potencial medido quando a célula contém a solução
tampão,
pH = valor de pH na solução amostra
pHt = valor de ph na solução tampão, e
K = variação do potencial por unidade de variação de pH -
teoricamente equivale a 0,0591631 + 0,000198 (t–25), em
que t corresponde à temperatura na qual se opera.
O valor de pH é expresso pela equação em relação ao pH
da solução padrão (pHp) e determinado em peagômetro
utilizando eletrodo de vidro.
Os aparelhos comercialmente utilizados para a
determinação de pH são instrumentos potenciométricos,
providos de amplificadores eletrônicos de corrente com
célula de vidro-calomelano, os quais são capazes de
reproduzir valores correspondentes a 0,02 de unidades
de pH. A escala de pH é calibrada não só em milivolts,
mas também em unidades correspondentes de pH. Dessa
forma, não há necessidade de se aplicar a equação acima,
que traduz a medida eletrométrica de pH. Uma vez que as
medidas de atividade hidrogênica são sensíveis a variações
de temperatura, todos os medidores de pH são equipados
com ajuste eletrônico de temperatura.
Soluções-tampão para calibração do medidor de pH
São empregadas visando à aferição do aparelho, permitindo
linearidade nas respostas em relação às alterações de
potencial observadas.As mais importantes são: tetraoxalato
de potássio 0,05 M, fosfato equimolar 0,05 M, tetraborato
de sódio 0,01 M, carbonato de sódio e hidróxido de cálcio
saturado a 25 ºC.
As soluções-tampão são preparadas da seguinte maneira:
Tetraoxalato de potássio, 0,05 M – Reduzir o tetraoxalato
de potássio a pó fino e dessecar em dessecador com sílica.
Dissolver exatamente 12,71g de KH3
(C2
O4
)∙2H2
O em água
para perfazer 1000 ml.](https://image.slidesharecdn.com/volume1-130912135211-phpapp01/85/Volume-1-121-320.jpg)





































![159Farmacopeia Brasileira, 5ª edição
5
5.2.29.16 DETERMINAÇÃO DE ESTERÓIS
EM ÓLEOS FIXOS
SEPARAÇÃO DA FRAÇÃO DE ESTERÓIS
Preparar a fração insaponificável. Separar a fração de
esteróis do óleo fixo por cromatografia em camada
delgada, utilizando uma placa de gel de sílica G (espessura
da camada entre 0,3 mm e 0,5 mm).
Solução amostra (a). Em balão de 150 mL, introduzir
volume de solução de betulina a 2 g/Lem diclorometano, que
corresponda a cerca de 10% do teor de esteróis da amostra
utilizada para o doseamento (por exemplo, volume de 500 μL
de solução de betulina no caso do óleo de oliva virgem, e de
1500 μL no caso de outros óleos vegetais). Se na monografia
estiver registrada a exigência do cálculo do teor percentual
de cada esterol na fração esterólica, a adição da betulina pode
ser omitida. Evaporar até a secura em corrente de nitrogênio.
Adicionar 5,00 g da amostra e adicionar 50 mL de hidróxido
de potássio alcoólico 2 M. Acoplar condensador de refluxo
vertical. Aquecer em banho-maria durante 1 h, sob agitação.
Arrefecer até temperatura inferior a 25 °C e transferir o
conteúdo do balão para um funil de separação, com o auxílio
de 100 mL de água. Agitar, com precaução, três vezes
com 100 mL de éter etílico isento de peróxidos. Reunir as
frações etéreas em outro funil de separação com o auxílio
de 40 mL de água destilada. Agitar suavemente durante
alguns minutos. Deixar separar as fases por decantação e
rejeitar a fase aquosa. Lavar a fase orgânica várias vezes
com 40 mL de água (a cada vez) até que a fase aquosa não
apresente reação alcalina a fenolftaleína. Transferir a fração
orgânica para um balão, tarado e lavar o funil de separação
com éter etílico. Evaporar o éter. Adicionar ao resíduo 6
mL de acetona. Eliminar, cuidadosamente, o solvente com
corrente de nitrogênio. Secar em estufa a 100 - 105 °C até
massa constante. Dissolver o resíduo com volume mínimo
de diclorometano.
Solução amostra (b).Submeter 5,00 g de óleo de canola
ao mesmo procedimento descrito para a Solução amostra
(a) a partir de “Adicionar 50 mL de hidróxido de potássio
alcoólico 2 M...”.
Solução problema (c). Submeter 5,00 g de óleo de girassol
ao mesmo procedimento descrito para a Solução problema
(a) a partir de “Adicionar 50 mL de hidróxido de potássio
alcoólico 2 M...”.
Solução padrão. Dissolver 25 mg de colesterol e 10 mg
de betulina em 1 mL de diclorometano. Utilizar uma placa
diferente para cada solução problema.
Aplicar, separadamente, 20 μL da Solução padrão em
forma de banda de 20 mm por 3 mm e 0,4 mL da solução
problema (a), (b) ou (c) em forma de banda de 40 mm por
3 mm. Migrar pela distância de 18 cm com a fase móvel
éter:n-hexano (35:65; v/v). Secar as placas em corrente de
nitrogênio. Revelar com solução de diclorofluoresceína a 2
g/L em etanol. Examinar em 254 nm.
O cromatograma obtido com a Solução padrão
apresenta bandas correspondentes, respectivamente, ao
colesterol e à betulina. Os cromatogramas obtidos com
as Soluções amostra apresentam bandas de Rf próximos
dos correspondentes aos esteróis. De cada um dos
cromatogramas raspar a região da placa correspondente às
bandas dos esteróis bem como uma zona situada 2 - 3 mm
para cima e para baixo das zonas visíveis correspondentes
à solução padrão. Colocar essas regiões em três erlenmeyer
diferentes de 50 mL. Adicionar a cada um, 15 mL de
diclorometano quente e agitar. Filtrar, separadamente, cada
solução por um filtro de vidro poroso (40), ou por filtro
de papel apropriado. Lavar, cada filtro, três vezes com 15
mL de diclorometano. Transferir o filtrado e líquidos de
lavagem em erlenmeyer, tarado. Evaporar até a secura em
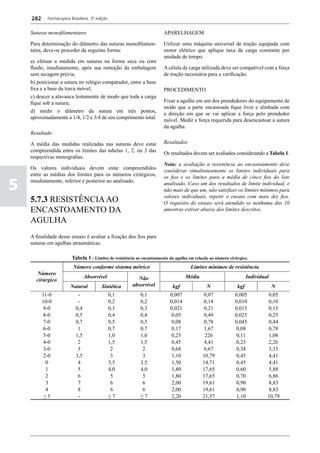
corrente de nitrogênio e pesar.
DOSEAMENTO DOS ESTERÓIS
Proceder por cromatografia a gás (5.2.17.5). O doseamento
deve ser realizado ao abrigo da umidade e preparar as
soluções no momento do uso.
Solução amostra. Aos esteróis separados a partir da amostra
por cromatografia em camada delgada, adicionar 0,02 mL
da mistura, recentemente preparada, de clorotrimetilsilano:
hexametildissilazano : piridina anidra (1:3:9; v/v/v)
por miligrama de resíduo. Agitar, cuidadosamente, até
dissolução completa dos esteróis. Deixar em repouso em
dessecador com pentóxido de difósforo durante 30 min.
Centrifugar, se necessário, e utilizar o sobrenadante.
Solução padrão (a). A nove partes dos esteróis separados
do óleo de canola por cromatografia em camada delgada,
juntar uma parte de colesterol. Adicionar 0,02 mL da
mistura, recentemente preparada, de clorotrimetilsila
no:hexametildissilazano:piridina anidra (1:3:9; v/v/v)
por miligrama de resíduo. Agitar, cuidadosamente, até
dissolução completa dos esteróis. Deixar em repouso em
dessecador com pentóxido de difósforo durante 30 min.
Centrifugar, se necessário, e utilizar o sobrenadante.
Solução padrão (b). Aos esteróis separados do óleo
de girassol por cromatografia em camada delgada,
juntar 0,02 mL da mistura, recentemente preparada,
de clorotrimetilsilano : hexametildissilazano : piridina
anidra (1:3:9; v/v/v) por miligrama de resíduo. Agitar,
cuidadosamente, até dissolução completa dos esteróis.
Deixar em repouso em dessecador com pentóxido de
difósforo durante 30 min. Centrifugar, se necessário, e
utilizar o sobrenadante.
Condições cromatográficas
- coluna de sílica fundida de 20 a 30 m de comprimento e
0,25-0,32 mm de diâmetro interno, recoberta por película
de poli[metil(95)fenil(5)]siloxano ou de poli[metil(94)
fenil(5)vinil(l)]siloxano (espessura da película 0,25 μm);
- gás de arraste: gás hidrogênio com fluxo de 30 a 50 cm/s
ou hélio com fluxo de 20 a 35 cm/s;
- razão de split (1/50 ou 1/100);
- temperaturas: coluna: 260 °C; injetor: 280 °C; detector:
290 °C;
- volume de injeção: 1 μL.](https://image.slidesharecdn.com/volume1-130912135211-phpapp01/85/Volume-1-159-320.jpg)


























![186 Farmacopeia Brasileira, 5ª edição
5
variação do teor do titulante em meio não aquoso em função da temperatura. Deve-se corrigir o volume do titulante,
multiplicando-o pelo fator de correção abaixo:
[1 + coeficiente de expansão cúbica do solvente (t0
- t)]
em que:
t0
= temperatura de padronização do titulante,
t = temperatura de utilização do titulante.
Os sistemas mais empregados para a titulação em meio não aquoso estão relacionados na Tabela 1.
Tabela 1 - Sistemas para titulação em meio não aquoso.
Tipo de solvente Solventea
Indicador Eletrodos
Ácido (para titulação
de bases ou seus sais)
Ácido acético glacial Alfazurina 2 G Mercúrio / Acetato de mercúrio
Ácido fórmico Cloreto de metilrosanilina Vidro / calomelano
Ácido propiônico p-Naftolbenzeína Vidro / prata / cloreto de prata
Anidrido acético Verde de malaquita
Cloreto de sulfonila Vermelho de quinaldina
Relativamente neutro
(para titulação
diferencial de bases)
Acetato de etila p-Naftolbenzeína Calomelano / prata / cloreto de
prata
Acetonitrila Vermelho de metila Vidro / calomelano
Álcoois Alaranjado de metila
Benzeno
Clorobenzeno
Clorofórmio
Dioxana
Básico (para titulação
de ácidos)
n-Butilamina p-Hidroxiazobenzeno Antimônio / calomelano
Dimetilformamida o-Nitroanilina Antimônio / vidro
Etilenodiamina Timolftaleína Platina / calomelano
Morfolina Violeta azóico Vidro / calomelano
Relativamente neutro
(para titulação
diferencial de ácidos)
Acetona Azul de bromotimol Antimônio / calomelano
Acetonitrila Azul de timol Vidro / calomelano
Álcool tert-butílico p-Hidroxiazobenzeno Vidro / platinab
2-Butanona Violeta azóico
Isopropilacetona
_____________
a) solventes relativamente neutros de constante dielétrica baixa, tais
como benzeno, clorofórmio, ou dioxana, podem ser utilizados junto com
qualquer solvente ácido ou básico a fim de aumentar a sensibilidade dos
pontos de viragem da titulação.
b) no titulante.
Titulação de substâncias básicas
Dissolver quantidade da substância indicada na monografia
em quantidade especificada do solvente, ou mistura de
solventes adequados. No caso da titulação de sais de
ácidos halogenados, deve-se adicionar 10 mL de acetato
de mercúrio SR. Adicionar o indicador apropriado, ou
no caso de determinação potenciométrica, empregar
eletrodo adequado titulando com ácido perclórico 0,1 M
SV em ácido acético. Para realização do ensaio em branco,
proceder da maneira descrita omitindo a amostra.
Se t0
for diferente de t corrigir o volume por:
[1 + 0,0011(t0
– t)]
em que:
t0
= temperatura na qual o titulante foi padronizado,
t = temperatura na qual a titulação foi realizada.
Titulação de substâncias ácidas
Método I - Dissolver quantidade da substância especificada
na monografia no solvente ou mistura de solventes
indicados. Adicionar o indicador recomendado ou, se
for o caso, usar o eletrodo adequado à determinação
potenciométrica. Titular com metóxido de sódio 0,1 M
SV previamente padronizada com ácido benzoico. Evitar
a absorção de dióxido de carbono. Efetuar titulação na
preparação em branco. Fazer as correções necessárias.
Método II - Dissolver quantidade da substância indicada na
monografia no solvente ou mistura de solventes indicados.](https://image.slidesharecdn.com/volume1-130912135211-phpapp01/85/Volume-1-186-320.jpg)