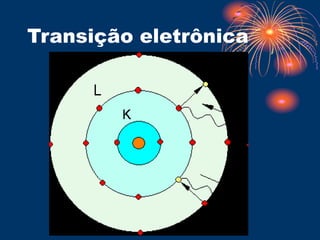
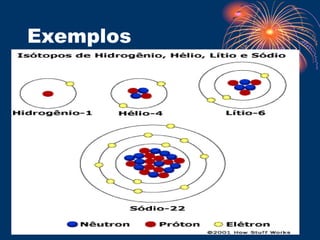
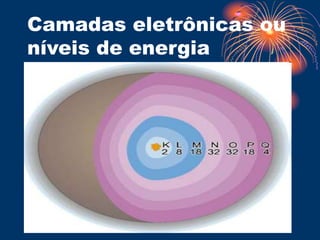
O documento descreve o modelo atômico de Bohr, que propôs que os elétrons giram em órbitas circulares em torno do núcleo em diferentes níveis de energia. O documento também explica os postulados de Bohr, como a transição eletrônica entre níveis de energia que emite fótons, e apresenta exemplos de testes de chama para detectar íons metálicos. Finalmente, o documento discute o modelo de subníveis de energia e o princípio da incerteza de Heisenberg.