1. Um gás a 20°C e 200 kPa realiza trabalho de 720 kJ em um recipiente adiabático de 2 m3, aumentando a entropia do sistema.
2. Gás inicialmente a 1200 kPa e 350°C é expandido para 140 kPa em processo adiabático reversível, calculando o trabalho específico assumindo calor específico constante.
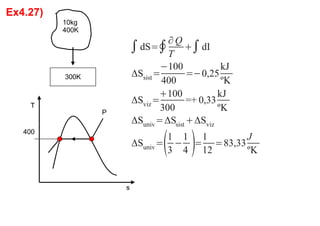
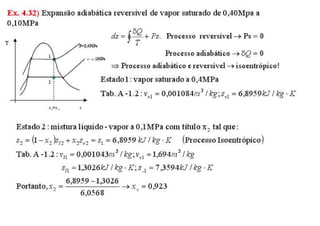
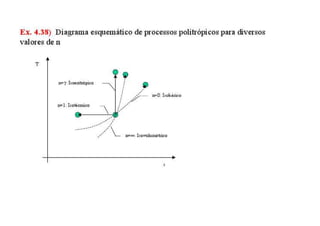
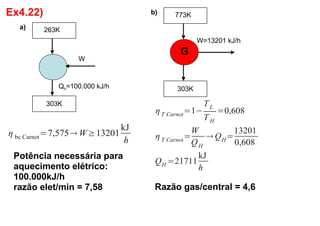
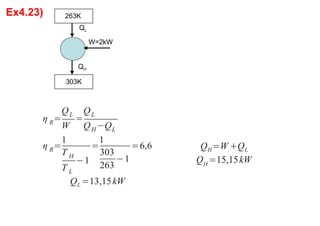
3. Exercícios resolvidos sobre primeira lei da termodinâmica, cálculo de taxa de transferência de calor, eficiência de ciclos, razão de potências













![Ex4.24)
Q
V=cte.
Adição de calor a volume constante
1ºLei: Q-W=∆∆∆∆U onde: [W=0]
∆∆∆∆U=CV ∆∆∆∆T=Q
Energia Interna aumenta (Q>0)
Temperatura aumenta (∆∆∆∆U>0)
Pressão aumenta (PV=MRT)[T↑↑↑↑]
Entalpia aumenta (H=U+PV)
Entropia:
∆S=cV ln
T2
T1
kln
V2
V1
∆S0 T2 T1
Troca de calor com
diferença de temperatura
→→→→Processo Irreversível
∆∆∆∆Ssist+viz>0](https://image.slidesharecdn.com/aula-10trans-161006163947/85/Aula-trans-calor-e-massa-16-320.jpg)