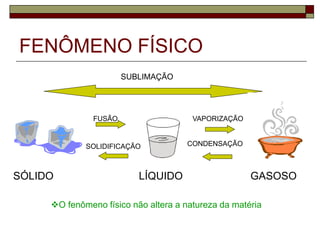
O documento aborda a composição e propriedades da matéria, distingui fenômenos químicos de físicos, e classifica substâncias e misturas. Discute os estados físicos (sólido, líquido e gasoso) e suas mudanças, assim como propriedades gerais e específicas das substâncias. Além disso, apresenta exemplos de sistemas homogêneos e heterogêneos, ressaltando a importância da definição de proporções e comportamentos em relação às mudanças de estado.