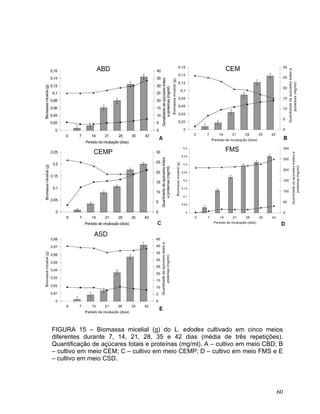
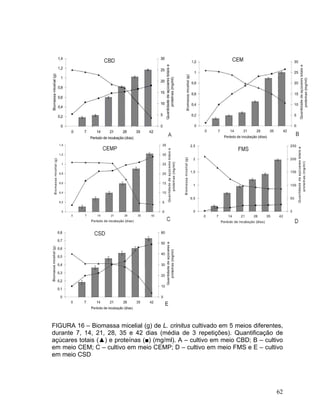
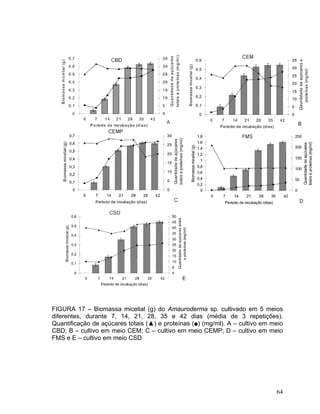
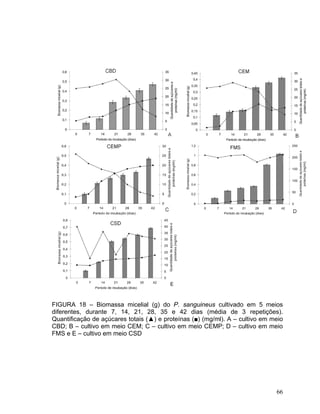
Este documento apresenta uma dissertação de mestrado que avalia a atividade antimicrobiana de quatro basidiomicetos: Lentinula edodes, Lentinus crinitus, Amauroderma sp. e Pycnoporus sanguineus. O trabalho descreve o cultivo dos fungos, a produção de biomassa, metabólitos e testa a atividade antimicrobiana dos extratos frente a bactérias e fungos patogênicos utilizando técnicas de difusão em ágar e cromatografia em camada delgada.





















































































![Eo S. et al. Antiviral activities of various water and methanol soluble substances
isolated from Ganoderma lucidum. Journal of Ethnopharmacology, v. 68, p. 129-
136, 1999.
SHLAES, D. M.; PROJAN, S. J.; EDWARDS Jr. J. E. Antibiotic Discovery: State of
the State. ASM News. V. 70, n. 6, p. 275-281, 2004.
SHOUJI, N. et al. Anticaries effect of a component from shiitake (an edible
mushroom). Caries Research. V. 34, p. 94-98. 2000.
SIGOILLOT, C. et al. Lignocellulolytic and hemicellulolytic system of Pycnoporus
cinnabarinus: isolation and characterization of a cellobiose dehydrogenase and a
new xylanase. Enzyme and Microbial Technology , v. 31, p. 876–883, 2002.
SIQUEIRA, E.M.A.; MIZUTA, K.; GIGLIO, J.R. Pycnoporus sanguineus: a novel
source of [alpha]-amylase. Mycological Research, v. 101, p. 188-190, 1997.
SMÂNIA Jr, A. et al. Growth and production phases of Pycnoporus sanguineus.
Revista Brasileira de Microbiologia. V. 26, p. 302-306, 1995a.
SMÂNIA Jr, A. et al. Antibacterial activity of a substance produced by the fungus
Pycnoporus sanguineus (Fr.) Murr. Journal of Ethnopharmacology, v.45, p. 177-
181, 1995b.
SMÂNIA, E.F.A. et al. Optimal parameters for cinnabarin synthesis by Pycnoporus
sanguineus. Journal of Chemistry and Technical Biotechnology v. 70, p. 57-59,
1997.
SMÂNIA E.F.A.; SMÂNIA Jr, A.; LOGUERCIO-LEITE, C. Cinnabarin synthesis by
Pycnoporus sanguineus strains and antimicrobial activity against bacteria from
food products. Brazilian Journal of Microbiology. v. 29, p.317-320, 1998.
SMÂNIA Jr, A. et al. Toxicity and antiviral activity of cinnabarin obtained from
Pycnoporus sanguineus (Fr.) Murr.
SMITH, G. M. Botânica Criptogâmica vol. 1: Algas e Fungos. 4ª ed. Fundação
Calouste Gulbenkian. 1987, 527p.
SPARRAT, M.C.N. et al. Screening for ligninolytic enzymes in autochthonous
fungal strains from Argentina isolated from different substrata. Revista
Iberoamericana de Micologia, v. 19, p. 181-185, 2002.
SPELHAUG S.R.; HARLANDER, S.K. Inhibition of foodborne bacterial pathogens
by bacteriocins from Lactococcus lactis and Pediococcus pentosaceous. Journal
of food protection. V. 52, p. 856-862, 1989
92](https://image.slidesharecdn.com/000658229-111026054033-phpapp01/85/000658229-101-320.jpg)
