Mc3a9todo de-feulgen1
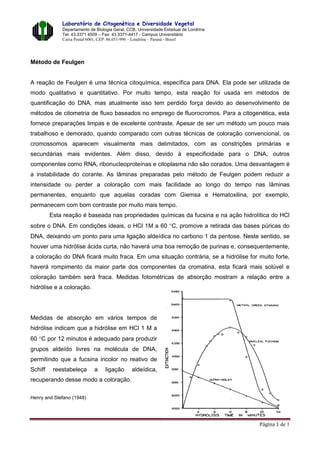
- 1. Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil Página 1 de 1 Método de Feulgen A reação de Feulgen é uma técnica citoquímica, específica para DNA. Ela pode ser utilizada de modo qualitativo e quantitativo. Por muito tempo, esta reação foi usada em métodos de quantificação do DNA, mas atualmente isso tem perdido força devido ao desenvolvimento de métodos de citometria de fluxo baseados no emprego de fluorocromos. Para a citogenética, esta fornece preparações limpas e de excelente contraste. Apesar de ser um método um pouco mais trabalhoso e demorado, quando comparado com outras técnicas de coloração convencional, os cromossomos aparecem visualmente mais delimitados, com as constrições primárias e secundárias mais evidentes. Além disso, devido à especificidade para o DNA, outros componentes como RNA, ribonucleoproteínas e citoplasma não são corados. Uma desvantagem é a instabilidade do corante. As lâminas preparadas pelo método de Feulgen podem reduzir a intensidade ou perder a coloração com mais facilidade ao longo do tempo nas lâminas permanentes, enquanto que aquelas coradas com Giemsa e Hematoxilina, por exemplo, permanecem com bom contraste por muito mais tempo. Esta reação é baseada nas propriedades químicas da fucsina e na ação hidrolítica do HCl sobre o DNA. Em condições ideais, o HCl 1M a 60 C, promove a retirada das bases púricas do DNA, deixando um ponto para uma ligação aldeídica no carbono 1 da pentose. Neste sentido, se houver uma hidrólise ácida curta, não haverá uma boa remoção de purinas e, consequentemente, a coloração do DNA ficará muito fraca. Em uma situação contrária, se a hidrólise for muito forte, haverá rompimento da maior parte dos componentes da cromatina, esta ficará mais solúvel e coloração também será fraca. Medidas fotométricas de absorção mostram a relação entre a hidrólise e a coloração. Medidas de absorção em vários tempos de hidrólise indicam que a hidrólise em HCl 1 M a 60 C por 12 minutos é adequado para produzir grupos aldeído livres na molécula de DNA, permitindo que a fucsina incolor no reativo de Schiff reestabeleça a ligação aldeídica, recuperando desse modo a coloração. Henry and Stefano (1948)
- 2. Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil Página 2 de 1 A pararosanilina, um componente da fucsina básica, é a responsável por estabelecer a ligação aldeídica que ficou disponível após a hidrólise. Assim, a fucsina que estava incolor no reativo de Schiff ganha um cor púrpura-lilás. Quando maior for a concentração de DNA no núcleo, mais intensa será a coloração, desde que a hidrólise prévia tenha sido adequada. Ao que parece, esta coloração não é eficaz para RNA por dois motivos: i) o RNA tem uma hidroxila no carbono 2 da pentose. Contudo a pararosanilina depende de um hidrogênio naquela posição para estabelecer a ligação aldeídica e ii) por ser de fita simples pode ser mais facilmente desnaturado nas condições de hidrólise. O preparo e a conservação do reativo de Schiff é crítico para um bom resultado na reação de Feulgen. A seguir colocamos alguns detalhes sobre o preparo e a conservação: Reativo de Schiff 1. Dissolva 1 g de fucsina básica em 200 mL de água destilada pré-aquecida a 60 C. Agite a solução constantemente com um bastão de vidro ou em agitador magnético até que a solução esfrie; 2. Adicione 10 mL de HCl 1M e homogeneíze a solução. O HCl deverá ser preparado na hora do uso, dissolvendo 0,835 mL de HCl P.A. em 9,165 mL de água destilada; 3. Adicione na sequência 2 g de metabissulfito de potássio e homogeneíze a solução durante 10 minutos usando um bastão de vidro ou um agitador. Ao adicionar o HCl e o metabissulfito, a solução liberará um gás de cheiro ruim e tóxico. Por isso, é aconselhável trabalhar dentro de uma capela com exaustão;
- 3. Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil Página 3 de 1 4. Transfira todo o volume para um frasco escuro ou encoberto por papel alumínio, tentando recuperar ao máximo o sedimento de fucsina. Homogeneíze várias vezes durante uma hora e guarde o frasco protegido da luz por pelo menos 24 horas; 5. Adicione o equivalente a uma colher das de sopa de carvão ativado em pó, homogeneíze algumas vezes ao longo de 4 horas. Filtre a solução em papel de filtro, diretamente para um frasco seguramente limpo, seco e protegido da luz. Neste ponto, a solução filtrada deverá estar completamente incolor; 6. Estoque em geladeira por tempo indeterminado; 7. Testa a capacidade de coloração pingando uma gota do filtrado em um pedaço de papel de filtro. Um corante adequado deverá produzir um halo púrpura-lilás no limite da área atingida, mantendo o interior branco. Se toda a área ficar corada logo no primeiro momento, proceda com novo tratamento com carvão ativado por 24 horas e nova filtragem. Faça isso sempre antes do uso, sobretudo quando a solução estiver estocada por um período longo. Reação de Feulgen para a obtenção de metáfases e fases da mitose e meiose 1. Retire as amostras pré-fixadas e lave-as em água destilada. Normalmente utilizamos pelo menos três banhos de 5 min cada, com agitação freqüente e com um volume de água maior que 20 vezes o volume da amostras; 2. Se as amostras forem muito duras, um tratamento com celulase (2%) e pectinase (20%) poderá ser incluído neste ponto. 3. Transfira as amostras para um frasco contendo HCl 1M, e deixe durante 10 a 12 minutos a a 60 C, preferivelmente em banho-maria; 4. Há alternativas para a hidrólise, como em HCl 5M por 30 minutos à temperatura ambiente. 5. Como as amostras ficarão bem moles depois da hidrólise, será difícil transferi-las para outro frasco, assim é aconselhável esgotar o ácido com uma pipeta e adicionar água destilada (20 vezes o volume da amostras ); 6. Lave as amostras por pelo menos 10 min, cheque a integridade dos meristemas usando uma lupa (estereomicroscópio); 7. Retire o máximo possível de água, sem deixar as raízes secarem, e adicione rapidamente o reativo de Schiff, com volume suficiente para cobrir as amostras. Agite a solução e deixe em ambiente totalmente escuro até que os meristemas fiquem com uma coloração púrpura-lilás bem forte;
- 4. Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil Página 4 de 1 8. Remova o corante e adicione água destilada (2 banhos de 10 minutos). Neste ponto é aconselhável usar frasco transparente e ambiente iluminado, para conseguir identificar os meristemas corados; 9. Transfira um ou mais meristemas para uma lâmina, enxugue o líquido e adicione rapidamente uma gota de ácido acético 45% (evite exposição longa ao ácido, pois ele remove a coloração e evite colocar uma gota com volume muito grande, pois haverá a chance de perder boas células pelas bordas da lamínula). O preparo das lâminas poderá ser feito também em carmim acético 1% ao invés de ácido acético 45%, porém, o carmim deixa precipitados, podendo sujar boas metáfases, apesar de acentuar a coloração; 10. Prepare a lâmina por dissecção e esmagamento; 11. Remova a lamínula em nitrogênio líquido, ou de outro modo e deixe secar na bancada; 12. Antes de montar a lâmina permanente, cheque a coloração; 13. Se houver algum problema na coloração, mas havendo muitas metáfases boas, a coloração poderá ser acentuada com uma exposição ao corante Giemsa 1% por um minuto (isso é feito para não perder a lâmina); 14. Monte a lâmina permanente usando Entellan, Permount ou Balsamo do Canadá e estoque-a em ambiente escuro.
