Propriedades coligativas e suas aplicações
- 2. • Tonoscopia • Ebulioscopia • Crioscopia • Osmose 2 Propriedades coligativas
- 3. • Diagrama de fases • Pressão de vapor • Tonoscopia • Ebulioscopia • Crioscopia • Osmose 3 Propriedades coligativas Conhecer previamente
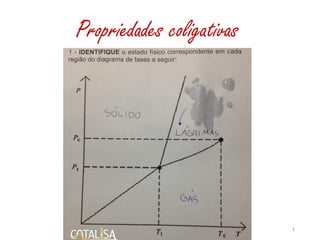
- 5. Diagrama de fases 5 Ponto triplo No ponto triplo as três fases – sólido, líquido e gasoso, estão em equilíbrio. O ponto triplo da água ocorre quando ela está à temperatura de 0,01°C sob pressão de 611,73 pascal.
- 6. Pressão de vapor • Pressão que o vapor exerce sobre seu líquido • Quanto maior a Pv de um líquido, mais volátil ele é 6
- 7. Pressão de vapor • Pressão que o vapor exerce sobre seu líquido • Quanto maior a Pv de um líquido, mais volátil ele é 7
- 8. Com a adição de um soluto não-volátil a um solvente, a solução obtida apresenta propriedades diferentes das do solvente puro Propriedades coligativas Dificulta a mudança de fase do solvente 8
- 9. Tonoscopia • É a diminuição da pressão de vapor de uma solução, provocada pela adição de um soluto não volátil 9
- 10. Tonoscopia • É a diminuição da pressão de vapor de uma solução, provocada pela adição de um soluto não volátil 10
- 12. Ebulioscopia • É a elevação da temperatura de ebulição de uma solução, devido ao acréscimo de soluto 12
- 13. Ebulioscopia • É a elevação da temperatura de ebulição de uma solução, devido ao acréscimo de soluto 13
- 15. Por que colocar sal na água para cozinhar o macarrão? 15 Exemplo
- 16. Por que colocar sal na água para cozinhar o macarrão? 16 Quantidade de soluto Pressão de vapor Elevação da TE Exemplo
- 17. Crioscopia • É a diminuição da temperatura de congelamento de uma solução 17
- 18. Crioscopia • É a diminuição da temperatura de congelamento de uma solução Quantidade de soluto Temperatura de congelamento 18
- 19. 19 Crioscopia
- 20. 20 Por que se coloca sal na neve? Por que se acrescenta sal ao gelo para gelar bebidas? Exemplo
- 21. 21 Manual do mundo (gelo + sal): https://www.youtube.com/watch?v=1im1fYiBWvo Garrafa de água: https://www.youtube.com/watch?v=Q-LH7mPcd5w Por que se coloca sal na neve? Por que se acrescenta sal ao gelo para gelar bebidas? Exemplo
- 22. Por que a vodca não congela no freezer? Por Redação Mundo Estranho Porque a temperatura necessária para fazer a bebida congelar fica um pouco abaixo dos 20 ºC negativos, a temperatura que um freezer costuma ter. Como isso é possível? Simples: graças ao baixíssimo ponto de congelamento do álcool etílico: 117 ºC negativos. A vodca contém entre 40% e 55% de álcool e essa quantidade é mais que suficiente para que a bebida suporte o frio do congelador sem sair do estado líquido. Mas o álcool não trabalha sozinho. “A vodca contém substâncias, como sais, que também reduzem seu ponto de congelamento”, diz o químico Flávio Maron Vichi, da USP. O que os sais fazem é aumentar o grau de desordem nas ligações das moléculas das Smirnoffs e Stolichnayas da vida. Isso deixa o líquido mais longe do congelamento, no qual atingiria o estado mais ordenado de todos: o sólido. Para congelar uma substância bagunçada pelos sais é preciso retirar mais energia dela. “Retirar mais energia”, em português claro, significa ter que baixar ainda mais a temperatura. Em outras bebidas que têm uma quantidade de álcool e sais parecida com a da vodca, como o uísque ou o conhaque, o processo é o mesmo. A diferença é que não os colocamos no freezer por costume. O hábito de fazer isso com a vodca se deve à natureza da bebida. A temperatura baixa impede que a gente sinta o sabor do destilado. E a graça da vodca é justamente ter o gosto mais neutro possível. 22
- 23. Osmose • É a passagem do solvente de uma solução diluída para outra mais concentrada, por meio de uma membrana semipermeável. 23
- 24. Exemplo Admita que uma célula viva contenha uma solução de concentração igual a 0,16 mol/L. Se essa célula for mergulhada em uma solução aquosa 0,05 mol/L, poderemos prever que: a) não haverá osmose. b) a célula inchará. c) a célula perderá água e murchará. d) a célula murchará e, após algum tempo, começará a inchar. e) a célula murchará e, em seguida, começará a murchar. 24