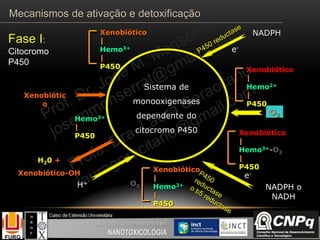
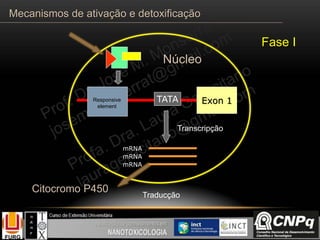
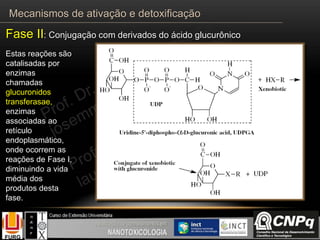
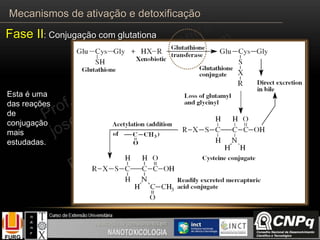
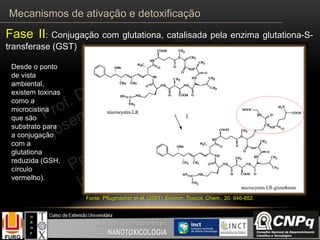
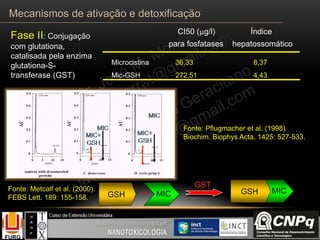
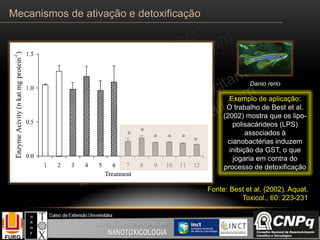
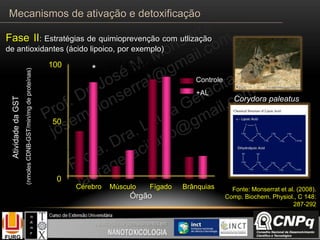
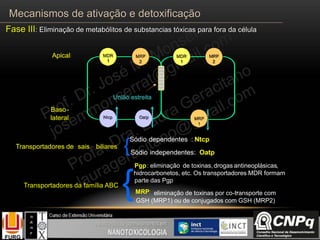
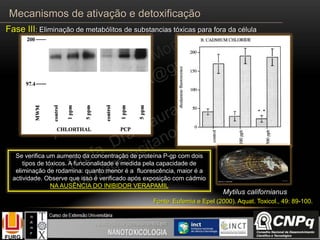
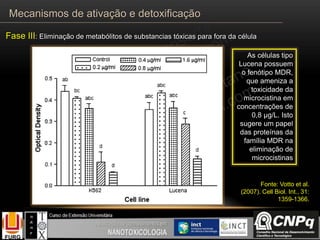
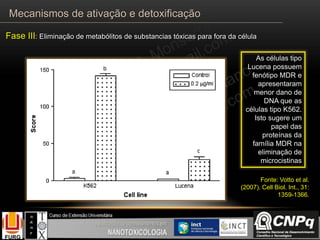
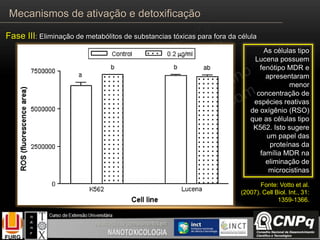
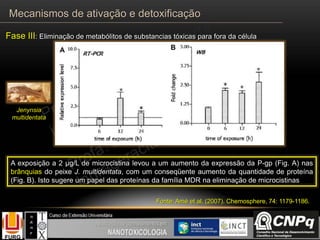
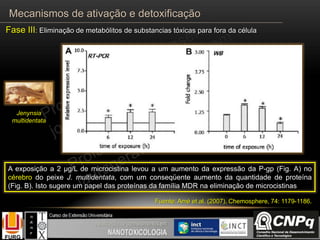
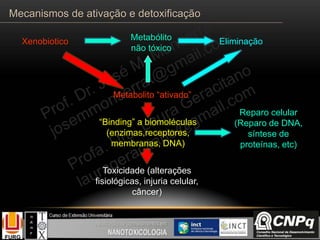
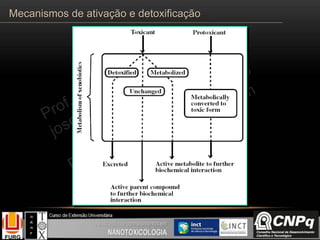
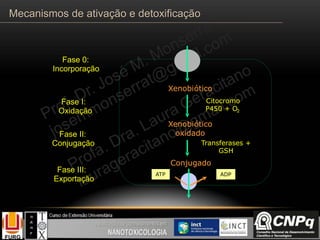
O documento descreve os principais mecanismos de ativação e detoxificação de compostos tóxicos no organismo, incluindo as fases 0, I, II e III do metabolismo de xenobióticos. A fase 0 envolve a incorporação do composto tóxico na célula. A fase I inclui reações de oxidação catalisadas pelo citocromo P450. A fase II envolve reações de conjugação, como conjugação com glutationa. A fase III é a eliminação dos metabólitos para fora da célula por transportadores




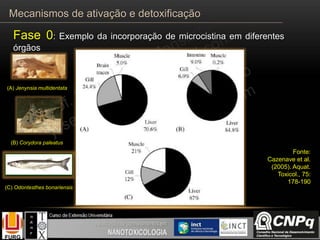
![Fase 0: Exemplo da incorporação da cianotoxina microcistina
Transportadores de ânions
orgânicos (OATPs)
Extracel.
Intracel.
OATP
GSH
MYC
HIPÓTESE
Aumento inicial
Depleção
Efeitos sobre a [glutationa] (GSH)
Mecanismos de ativação e detoxificação](https://image.slidesharecdn.com/toxicologia-151008215035-lva1-app6892/85/Toxicologia-8-320.jpg)
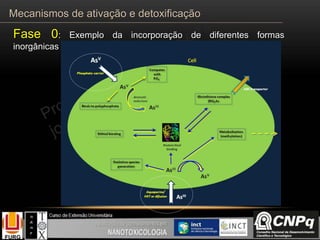
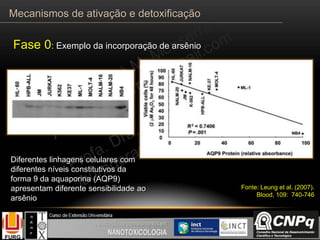
![Incluem reações
que podem estar
associadas a um
aumento da
toxicidade do
composto
parental
O processo
fisiológico
normal
OHCH3
CH3
O
P450 aromatase
Testosterona
OH
CH3
OH
Estradiol
1
2
3
4
567
8
9
10
11
12
benzo[a]pireno
O
benzo[a]pireno 4,5 epoxido
Epoxidação
Hidroxilação
Fase I
Mecanismos de ativação e detoxificação](https://image.slidesharecdn.com/toxicologia-151008215035-lva1-app6892/85/Toxicologia-12-320.jpg)