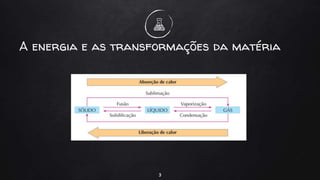
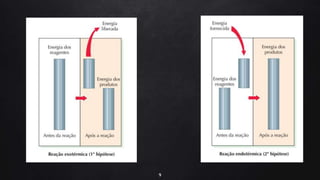
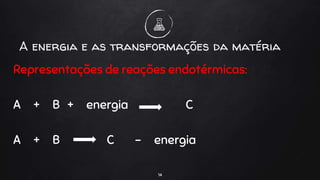
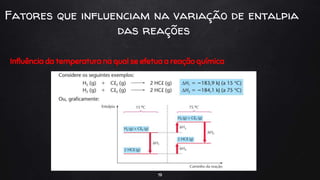
O documento discute a termoquímica, que estuda as quantidades de calor liberadas ou absorvidas durante reações químicas. Reações exotérmicas liberam calor, enquanto reações endotérmicas absorvem calor. A variação de entalpia em uma reação depende das quantidades de reagentes e produtos, bem como de seus estados físicos e alotrópicos e da temperatura da reação.