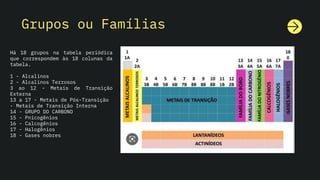
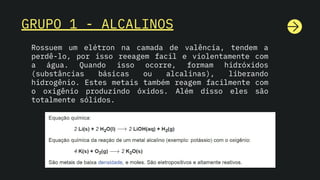
O documento aborda a tabela periódica, explicando seus grupos e períodos, além das características e propriedades dos elementos. Destaca a diferença entre massa atômica e número de massa, e discute tipos de átomos, como metais, ametais e isótopos. Também descreve as reações químicas de diferentes grupos de elementos, como alcalinos, gases nobres e halogênios.