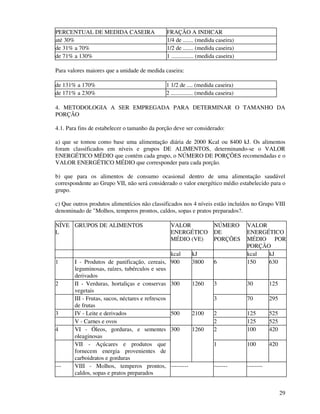
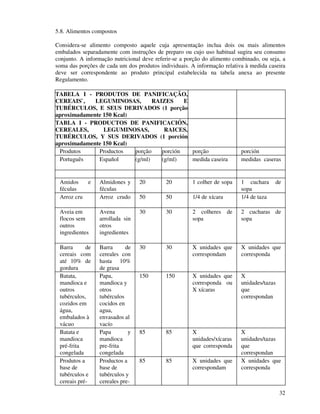
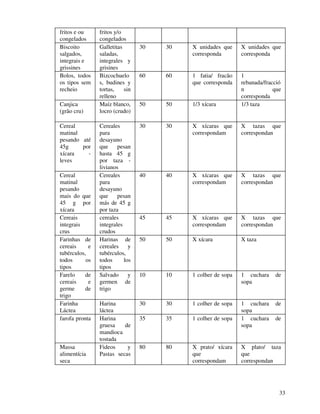
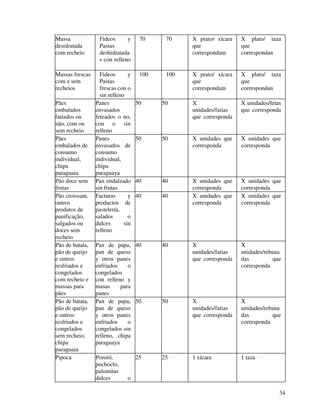
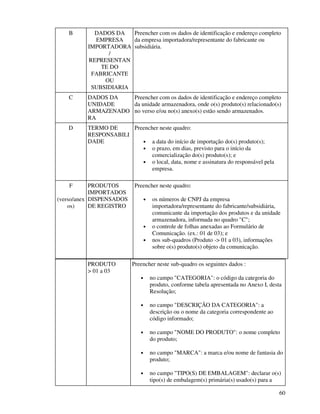
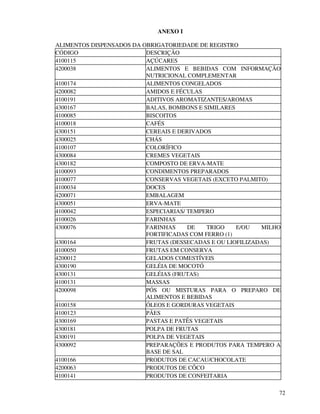
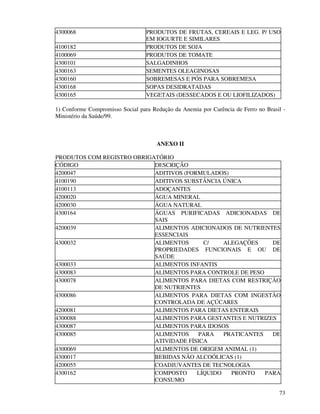
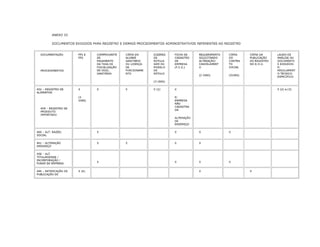
1. O documento apresenta as diretrizes para rotulagem de alimentos no Brasil de acordo com decretos e resoluções, incluindo informações obrigatórias nos rótulos e propaganda de alimentos.
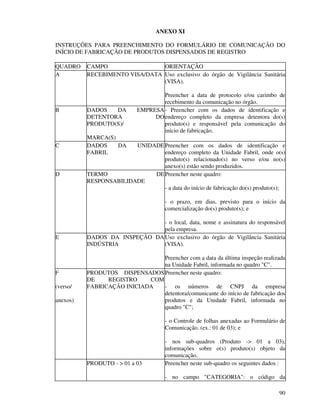
2. São descritos os procedimentos para registro de alimentos, aditivos, embalagens e equipamentos junto ao órgão competente do Ministério da Saúde para que possam ser comercializados.
3. As análises de controle realizadas após o registro servem para verificar a conformidade dos produtos com os padrões exigidos