O documento discute patentes de medicamentos no Brasil, incluindo análise pelo INPI e ANVISA, políticas públicas de acesso a medicamentos e licença compulsória. Resume os principais pontos da introdução às patentes, o processo de análise pelo INPI e ANVISA, e como as políticas públicas e licença compulsória equilibram inovação e acesso.




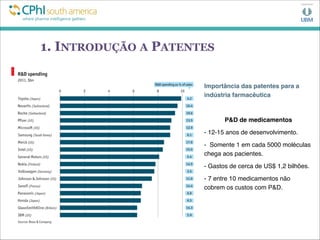


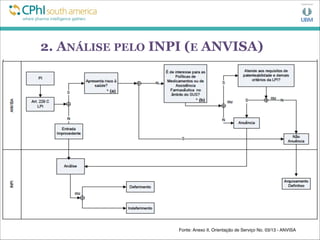
![2. ANÁLISE PELO INPI (E ANVISA)
INPI
Art. 2º Lei No. 5.648/70 (alterada pela Lei 9.279/96):
“O INPI tem por finalidade principal executar, no âmbito nacional, as
normas que regulam a propriedade industrial, tendo em vista a sua
função social, econômica, jurídica e técnica [...].” [grifos nossos]
ANVISA
Art. 6º Lei No. 9.782/99:
“A Agência terá por finalidade institucional promover a proteção da
saúde da população, por intermédio do controle sanitário da
produção e da comercialização de produtos e serviços submetidos
à vigilância sanitária [...].” [grifos nossos]](https://image.slidesharecdn.com/edsoncphi-130807123439-phpapp02/85/CPhI07-08-13EdsonPSouza-8-320.jpg)

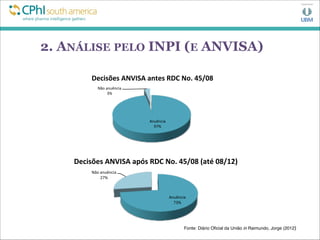


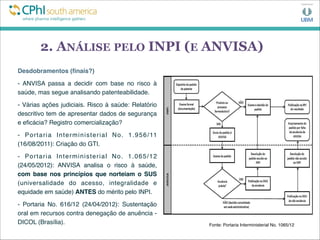




![5. CONCLUSÃO
Ambiente regulatório e políticas públicas vs Inovação:
- WHO Priority Medicines Report (2013)
“A capacidade das maiores indústrias farmacêuticas de
inovar está sob pressão crescente da perda de receita
advinda da expiração de patentes [para seus blockbusters],
sistemas de saúde limitados por custos, e requisitos
regulatórios mais estringentes. Consequentemente, está
ficando cada vez mais difícil prover incentivos apropriados
para o desenvolvimento de produtos de grande importância
para a saúde pública.” [tradução livre]](https://image.slidesharecdn.com/edsoncphi-130807123439-phpapp02/85/CPhI07-08-13EdsonPSouza-19-320.jpg)