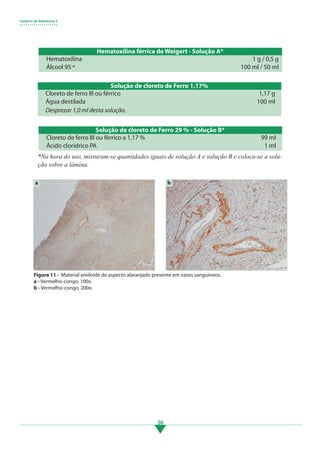
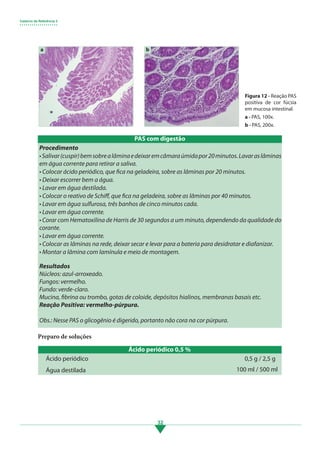
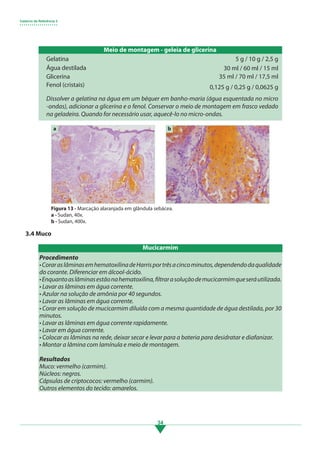
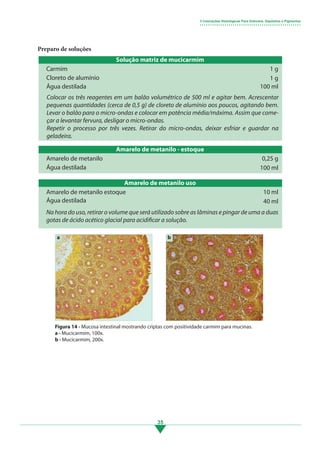
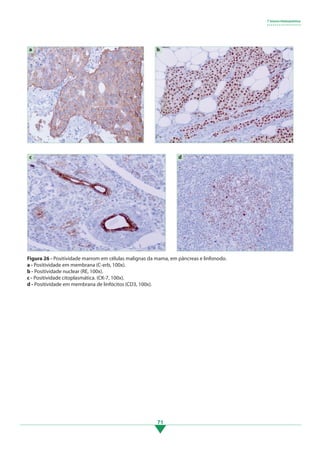
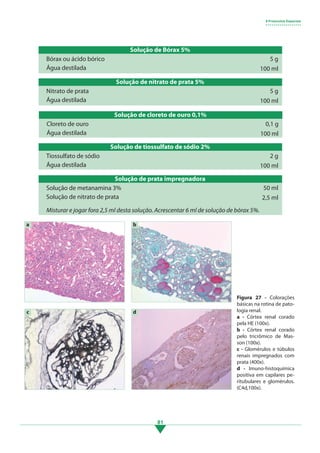
Os principais pontos deste tópico são:
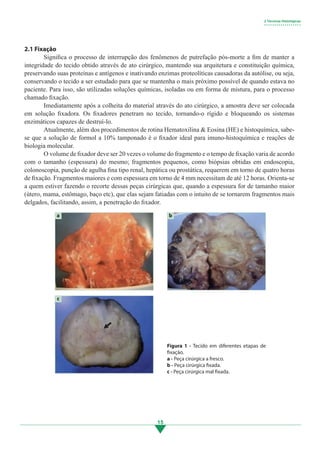
1. A fixação é o processo de interrupção da autólise pós-morte para preservar a estrutura e constituição do tecido.
2. Isso é feito usando soluções químicas que penetram no tecido, tornando-o rígido e bloqueando enzimas de degradação.
3. A solução padrão é formol a 10% tamponado, ideal para análises histológicas, histoquímicas, imuno-histoquímica e biologia molecular.
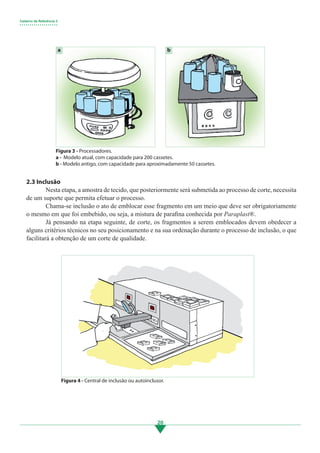
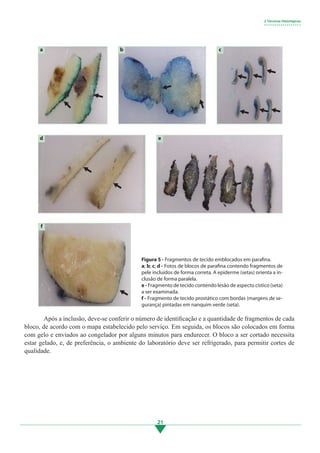
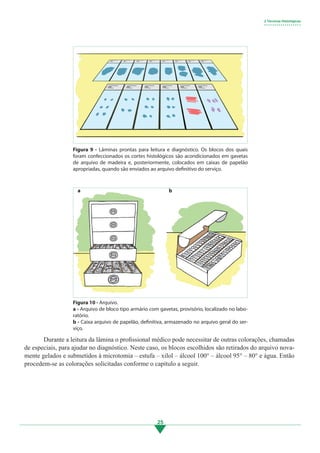
4.