Este documento apresenta uma dissertação de mestrado sobre a adsorção de íons metálicos de efluentes aquosos usando bagaço do pedúnculo de caju como adsorvente. O estudo foi realizado em duas etapas: adsorção em batelada e adsorção em coluna de leito fixo. Na primeira etapa, foram avaliados os efeitos do tratamento químico, tamanho de partículas, concentração de adsorvente e pH na remoção dos metais. Na segunda etapa, foram otimizadas as condi

















































































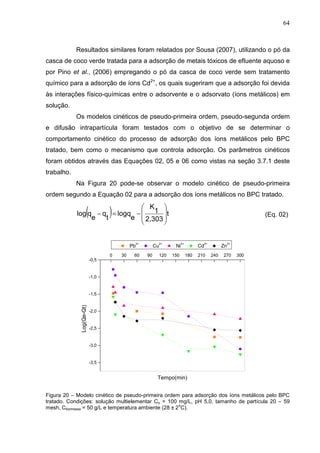












































![110
Os valores obtidos das curvas de ruptura dos íons metálicos foram
usados para calcular os parâmetros tx, tσ, tf, f e o percentual de saturação da coluna,
os resultados estão apresentados nas Tabelas 35 e 36.
Os resultados obtidos a partir das curvas de ruptura dos elementos
contidos na amostra de efluente real em pH 7,0 mostraram que o tempo total para o
estabelecimento da zona de adsorção primária (tx) ficou entre 10 – 510 min, e para
amostra em pH 5,0, ficou entre 10 – 217 min. O tempo necessário para movimentar
a zona de adsorção ao longo da coluna (tσ), em pH 7,0 ficou entre 7 – 387 min e em
pH 5,0 entre 7 – 160 min. O tempo para formação da zona de adsorção primária (tf)
em pH 7,0, encontrou-se entre 3 – 117 min, e para pH 5,0 entre 2 – 57 min. O
percentual de saturação da amostra em pH 7,0 para os íons Cu2+
e Zn2+
ficou em
torno de 70%, e para o íon Ni2+
em torno de 50%. Enquanto que a amostra com pH
corrigido para 5,0 apresentou 50% de saturação para Cu2+
e Ni2+
, e em torno de
64,71% para Zn2+
.
Ao analisarmos uma solução com pH 5,0, concluímos que a concentração
de íons hidrônios [H3O+
] é maior do que a concentração de íons hidroxila [OH-
], ou
seja, [H3O+
] > [OH-
] e temos uma solução aparentemente ácida. Da mesma forma,
se temos uma solução em pH 7,0, a concentração dos íons hidrônios [H3O+
] é igual
a concentração dos íons hidroxila [OH-
], ou seja, [H3O+
] = [OH-
] e temos uma
solução aparentemente neutra. Assim, o efeito de competição entre os íons
metálicos e os íons H3O+
, pelos sítios de adsorção disponíveis no bagaço do
pedúnculo de caju tratado, será mais acentuado em pH 5,0 do que em pH 7,0.
Sendo esse o motivo de haver diminuição do percentual de saturação dos íons
metálicos observados na amostra de efluente real com pH ajustado para 5,0.
Tabela 35 - Parâmetros tx, tσ, tf, f, δ e o percentual de saturação da coluna (%S) para amostra de
efluente real em pH 7,0.
Íon metálico tx (min.) tσ (min.) tf (min.) f δ (cm) % S
Cu2+
13 10 3 0,686 11,7 69,26
Ni2+
10 7 3 0,500 12 50,10
Zn2+
510 387 117 0,695 11,8 70,21](https://image.slidesharecdn.com/2008dissamarajo-161026201127/85/2008-dis-samaraujo-128-320.jpg)






















