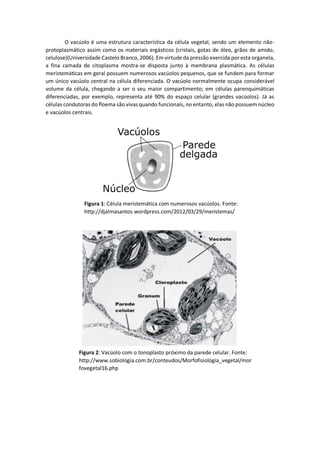
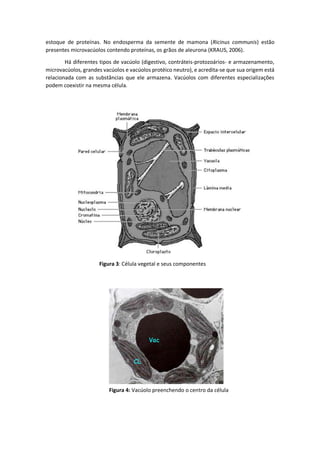
O documento descreve a estrutura e função do vacúolo nas células vegetais. O vacúolo é uma organela que armazena substâncias como água, íons e metabólitos e desempenha papéis importantes como manutenção da pressão de turgor e digestão intracelular. O documento detalha a composição do tonoplasto, membrana do vacúolo, e os transportadores iônicos nela presentes.